
【题目】一定条件下存在反应:2SO2(g)+ O2 (g)![]() 2SO3(g),其正反应放热。现有三个体积相同的密闭容器
2SO3(g),其正反应放热。现有三个体积相同的密闭容器
I、II、III,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是

A. 容器I、III中平衡常数相同
B. 容器II、III中正反应速率相同
C. 容器II、III中的反应达平衡时, SO3的体积分数:II > III
D. 容器I中SO2的转化率与容器II中SO3的转化率之和小于1
【答案】CD
【解析】
A.容器Ⅰ是绝热容器,反应过程中温度升高,平衡逆向进行,平衡常数减小,容器Ⅰ、Ⅲ中平衡常数不相同,故A项错误;
B.容器Ⅲ是恒压容器,反应过程中压强小于容器Ⅱ,反应速率小,容器Ⅱ、Ⅲ中正反应速率不相同,故B项错误;
C.容器Ⅱ是恒温恒容,Ⅲ是恒温恒压,随着反应的进行,容器Ⅱ中压强大于容器Ⅲ,平衡正向进行,三氧化硫含量增大,SO3的体积分数:Ⅱ>Ⅲ,故C项正确;
D.若容器Ⅱ恒温恒容,容器Ⅰ也是恒温恒容时,达到相同平衡状态,二氧化硫转化率和三氧化硫转化率之和为1,但实际容器Ⅰ是绝热恒容,随反应进行温度升高,平衡逆向进行,二氧化硫转化率减小,因此容器Ⅰ中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1,故D项正确;
故答案选CD。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于硅的说法不正确的是( )
A. 硅是非金属元素,它的单质是灰黑色有金属光泽的固体
B. 硅的导电性能介于金属和绝缘体之间,是良好的半导体材料
C. 硅的化学性质不活泼,常温下不与任何物质反应
D. 粗硅的冶炼反应,体现了高温下SiO2的弱氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钙(Ca3N2)氮化钙是一种棕色粉末,在空气中氧化,遇水会发生水解,生成氢氧化钙并放出氨。某化学兴趣小组设计制备氮化钙并测定其纯度的实验如下:
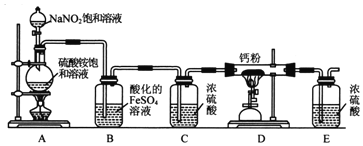
Ⅰ.氮化钙的制备
(1)连接装置后,检查整套装置气密性的方法是_____________________。
(2)装置A中每生成标准状况下4.48LN2,转移的电子数为___________________。
(3)装置B的作用是吸收氧气,则B中发生反应的离子方程式为__________。装置E的作用是______________________。
(4)实验步骤如下:检查装置气密性后,装入药品;_____________________(请按正确的顺序填入下列步骤的代号)。
①加热D处的酒精喷灯; ②打开分液漏斗活塞; ③加热A处的酒精灯;④停上加热A处的酒精灯;⑤停止加热D处的酒精喷灯
(5)请用化学方法确定氮化钙中含有未反应的钙,写出实验操作及现象___________。
Ⅱ.测定氮化钙的纯度:
①称取4.0g反应后的固体,加入足量水,将生成的气体全部蒸出并通入100.00mL1.00mol·L-1盐酸中,充分反应后,将所得溶液稀释至200.00mL;
②取20.00mL稀释后的溶液,用0.20mol·L-1NaOH标准溶液滴定过量的盐酸,达到滴定终点时,消耗标准溶液25.00mL。
(1)氮化钙的质量分数为_________。
(2)达到滴定终点时,仰视滴定管读数将使测定结果_________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1mol/L二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数![]() 随pH的变化如图所示[已知
随pH的变化如图所示[已知 ]。
]。

下列叙述错误的是
A. pH=1.2时,c(H2A)=c(HA-)
B. lg[K2(H2A)]=-4.2
C. pH =2.7时,c(HA-)>c(H2A)=c(A2-)
D. pH=4.2时,c(HA-)=c(A2-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 常温时,在c(H+)=![]() 的溶液:Na+、Al3+、Cl-、S2-
的溶液:Na+、Al3+、Cl-、S2-
B. 由水电离的c(H+)=10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C. c(OH-)/c(H+)=10-12的溶液中:NH4+、Al3+、NO3-、Cl-
D. 加入金属铝能放出大量H2的溶液:NH4+、K+、HCO3-、CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中属于吸热反应的是
①液态水汽化 ②碳酸钙分解 ③苛性钠固体溶于水 ④C与H2O制水煤气 ⑤生石灰跟水反应生成熟石灰 ⑥干冰升华
A. ①②④B. ②④C. ③⑤D. ①②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]________,有________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是_______________________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_____________________。
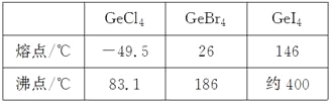
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为____________,微粒之间存在的作用力是________________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(1/2,0,1/2);C为(1/2,1/2,0)。则D原子的坐标参数为________。

②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的措施是( )
A. 向水中通入SO2 B. 将水加热煮沸
C. 向纯水中投入一小块金属钠 D. 向水中加入NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下表是室温下,几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb):

请回答下面问题:
(1)用蒸馏水稀释0.1mol/L的醋酸溶液,下列选项中一定变小的是_____
A.c(H+) B.c(H+)·c(OH-) C. ![]()
(2)CH3COONH4的水溶液呈_______(选填酸性”、“中性"或“碱性”)。
(3)浓度为0.10mol/L柠檬酸氢二钠(Na2HC6H5O7)溶液显酸性,通过计算说明其原因______。
(4)工业中常用碳酸镍制备氧化镍。已知:Ksp(NiCO3)=1.4×10-7,当Ni,2+恰好完全转化为NiCO3沉淀[即溶液中c(Ni2+)=1×10-5mol·L-1]时,溶液中c(CO32-)=_____mol/L。
II.(1)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) △H=akJ/mol
CH3CH2OH(g)+3H2O(g) △H=akJ/mol
在一定压强下,测得.上述反应的实验数据如下表。

根据表中数据分析:
①上述反应的a_____0(填"大于”或“小于”)。
②在一定温度下.提高氢碳[即![]() ]比,平衡常数K值_____(填“增大”、“减小”、或"不变”)。
]比,平衡常数K值_____(填“增大”、“减小”、或"不变”)。
(2)催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示;

根据上图,写出反应的热化学方程式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com