
(16分)甲醇是新型的汽车动力燃料。工业上可通过H2和CO化合制备甲醇,该反应的热化学方程式为:2H2(g)+CO(g) CH3OH(g)
CH3OH(g)
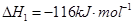
(1)已知: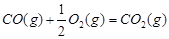
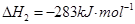
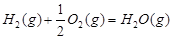
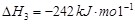
1
mol甲醇气体完全燃烧生成CO 和水蒸气的热化学方程式为
。
和水蒸气的热化学方程式为
。
(2)下列措施中有利于提高2H2(g)+CO(g) CH3OH(g)反应速率的是
(双选)。
CH3OH(g)反应速率的是
(双选)。
A.分离出CH3OH B.升高温度 C.减小压强 D.加入合适的催化剂
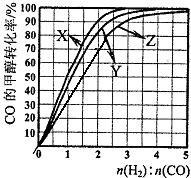
(3)(3)用H2和CO化合制备甲醇的反应中,若反应的容积为1L的恒容容器,分别在230℃、250℃和270℃下,改变H2和CO的起始组成比(起始时CO的物质的量固定为1mol)进行实验,结果如下图所示(图中曲线上的点都为一定温度下、一定组成下的平衡点):
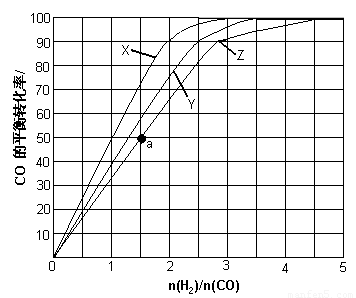
①曲线X对应的温度是 。
②从图中可以得出的结论有 (任写一条)。
(4)若往反应的容积中加入1.5molH2 和1.0molCO,在曲线Z对应温度下反应达平衡。利用上述图中a点对应的CO平衡转化率,计算2H2(g)+CO(g) CH3OH(g)的平衡常数。(写出计算过程)
CH3OH(g)的平衡常数。(写出计算过程)
(1) 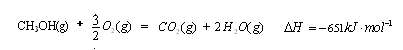 (3分)
(3分)
(2)BD (4分) (3)①230℃(3分)
②其他条件不变,CO的平衡转化率随着H2与CO的起始组成比增大而增大(或:其他条件不变,CO的平衡转化率随温度升高而降低。) (2分)
(4)a点H2与CO的起始组成比为1.5,CO的平衡转化率为50%。(1分)
2H2(g)+CO(g) CH3OH(g)
CH3OH(g)
起始物质的量(mol) 1.5 1 0
转化物质的量(mol) 1 0.5 0.5
平衡物质的量(mol) 0.5 0.5 0.5
平衡浓度(mol/L) 0.5 0.5 0.5 (1分)
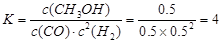 (2分)
(2分)
【解析】(1)考查盖斯定律的应用。根据已知反应可知,②+③×2-①即得到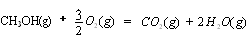 ,所以反应热是-283kJ/mol-242 kJ/mol×2+116 kJ/mol=-651 kJ/mol.
,所以反应热是-283kJ/mol-242 kJ/mol×2+116 kJ/mol=-651 kJ/mol.
(2)考查外界条件对反应速率对影响。增大反应物的浓度或升高温度或使用催化剂等都可以加快反应速率,BD正确,AC都是降低反应速率的,答案选BD。
(3)①应用反应是放热反应,所以温度越高,转化率越低。X曲线表示的转化率最大,所以温度最低,即X表示的是230℃。
②根据图像可知,其他条件不变,CO的平衡转化率随着H2与CO的起始组成比增大而增大。
(4)考查平衡常数的有关计算。
a点H2与CO的起始组成比为1.5,CO的平衡转化率为50%
2H2(g)+CO(g) CH3OH(g)
CH3OH(g)
起始物质的量(mol) 1.5 1 0
转化物质的量(mol) 1 0.5 0.5
平衡物质的量(mol) 0.5 0.5 0.5
平衡浓度(mol/L) 0.5 0.5 0.5
所以 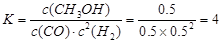


科目:高中化学 来源: 题型:
| 常温 |
| 1 |
| 2 |
| 1 |
| 2 |
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ?mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
| 3 |
| 2 |
| 3 |
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 化学键 | C-C | C-H | H-H | C-O | C≡O(CO) | H-O |
| 键能/kJ?mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:2012届广东省连州市连州中学高三10月月考理科综合化学试卷(带解析) 题型:计算题
(16分)甲醇是新型的汽车动力燃料。工业上可通过H2和CO化合制备甲醇,该反应的热化学方程式为:2H2(g)+CO(g) CH3OH(g)
CH3OH(g) 
(1)已知:



1 mol甲醇气体完全燃烧生成CO 和水蒸气的热化学方程式为 。
和水蒸气的热化学方程式为 。
(2)下列措施中有利于提高2H2(g)+CO(g) CH3OH(g)反应速率的是 (双选)。
CH3OH(g)反应速率的是 (双选)。
| A.分离出CH3OH | B.升高温度 | C.减小压强 | D.加入合适的催化剂 |

 CH3OH(g)的平衡常数。(写出计算过程)
CH3OH(g)的平衡常数。(写出计算过程)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com