
设nA为阿伏加德罗常数的数值,下列说法正确的是
| A.3mol NO2与水充分反应,转移nA个电子 |
| B.常温常压下,18g H2O含有3nA个原子 |
| C.1L 0.1 mol·L-1NaHCO3溶液中含有0.1nA个HCO3- |
| D.标准状况下,2.24L乙醇含有0.1nA个CH3CH2OH分子 |
B
解析试题分析:A、根据反应3NO2+H2O=2HNO3+NO可知3个NO2分子中有2个NO2中的N由+4价升高到+5价,有1个NO2中的N由+4价降低到+2价,故3mol NO2与水充分反应,转移2nA个电子,故A错误;B、根据n=m/M=18g/18g/mol=1mol,1个H2O中含有3个原子,故常温常压下,18g H2O含有3nA个原子,故B正确;C、NaHCO3中的HCO3-即能电离HCO3- H++CO32-,又能水解HCO3-+H2O
H++CO32-,又能水解HCO3-+H2O H2CO3+OH-,故1L 0.1 mol·L-1NaHCO3溶液中含有HCO3-小于0.1nA个,故C错误;D、标准状况下,乙醇为液体,2.24L乙醇的物质的量不等于1mol,D错误。
H2CO3+OH-,故1L 0.1 mol·L-1NaHCO3溶液中含有HCO3-小于0.1nA个,故C错误;D、标准状况下,乙醇为液体,2.24L乙醇的物质的量不等于1mol,D错误。
考点:考查阿伏加德罗常数。


科目:高中化学 来源: 题型:单选题
下列化学用语或模型表示不正确的是
A.中子数为14的硅原子: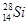 |
B.CH4分子的比例模型: |
C.聚乙烯的结构简式: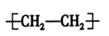 |
| D.次氯酸分子的结构式:H—O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.常温常压下,NO2和N2O4的混合物46g中含有2NA个氧原子 |
| B.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA |
| C.10mL98%的浓H2SO4用水稀释至l00mL,H2SO4的质量分数为9.8% |
| D.标准状况下,80g SO3中含3NA个氧原子,体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
20mL 1mol ·L_1NaOH与1mol ·L_1的硫酸反应,溶液呈中性,则硫酸的体积为 ( )
| A.5 mL | B.l0 mL |
| C.20 mL | D.40 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
甲、乙、丙是三种不含相同离子的可溶性强电解质。它们所含离子如下表所示:
| 阳离子 | NH、Na+、Mg2+ |
| 阴离子 | OH-、NO3—、SO42— |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收。利用图所示装置加热硫酸铜粉末直至完全分解。硫酸铜粉末质量为10.0 g,完全分解后,各装置的质量变化关系如下表所示。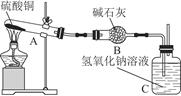
| 装置 | A(试管+粉末) | B | C |
| 反应前 | 42.0 g | 75.0 g | 140.0 g |
| 反应后 | 37.0 g | 79.5 g | 140.0 g |
 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑  3CuO+SO3↑+2SO2↑+O2↑
3CuO+SO3↑+2SO2↑+O2↑ 5CuO+SO3↑+4SO2↑+2O2↑
5CuO+SO3↑+4SO2↑+2O2↑  6CuO+4SO3↑+2SO2↑+O2↑
6CuO+4SO3↑+2SO2↑+O2↑查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关一定物质的量浓度的溶液配制的过程中,造成所得的溶液浓度偏大的是( )。
| A.要配制100 mL 1 mol·L-1 NaOH溶液,需在白纸上称4 g NaOH固体,并且称量速度较慢 |
| B.称量时托盘天平的砝码已被锈蚀 |
| C.溶解或稀释溶质时烧杯尚未干燥 |
| D.定容时盖上瓶盖,摇匀后发现液面低于刻度线,再继续滴加蒸馏水使液面重新达到刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
设NA为阿伏加德罗常数的数值,下列说法不正确的是( )
| A.常温下,1 L pH=1的硫酸溶液中含有的H+为0.1NA |
| B.常温下,14 g C2H4和C3H6的混合气体中含有2NA个氢原子 |
| C.2.3 g Na和足量的O2完全反应,在常温和燃烧时,转移电子数均为0.1NA |
| D.1 mol甲醇中含有C—H键的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
两种硫酸盐按一定比例混合后共熔,可制得化合物X,X溶于水能电离出K+、Cr3+、SO42—,若将2.83 g X中的Cr3+全部氧化为Cr2O72—后,溶液中的Cr2O72—可和过量KI溶液反应,得到3.84 g I2。反应的离子方程式为Cr2O72—+6I-+14H+=2Cr3++3I2+7H2O。若向溶有2.83 g X的溶液中,加入过量的BaCl2溶液,可得到4.66 g白色沉淀,由此可推断出X的化学式为( )
| A.K2SO4·Cr2(SO4)3 | B.2K2SO4·Cr2(SO4)3 |
| C.K2SO4·2Cr2(SO4)3 | D.K2SO4·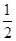 Cr2(SO4)3 Cr2(SO4)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com