
| 编号 | 起始温度T1/℃ | 终止温度T2/℃ | 平均温度差T2-T1/℃ | △H | ||
| 盐酸 | NaOH | 平均值 | ||||
| 1 | 26.2 | 26.0 | 26.1 | 29.2 | ------- | ------- |
| 2 | 25.9 | 25.9 | 25.9 | 29.2 | ||
| 3 | 26.4 | 26.2 | 26.3 | 29.5 | ||
分析 (1)根据中和热测定的实验步骤选用需要的仪器,然后判断还缺少的仪器;
(2)根据中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,标注物质聚集状态和对应焓变写出热化学方程式;
(3)根据中和热是在稀溶液中强酸与强碱生成1molH2O放出的热量,注意弱电解质的电离吸热,浓硫酸溶于水放热来解答;
(4)先判断温度差的有效性,然后求出温度差平均值;根据Q=m•c•△T计算反应放出的热量,然后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热;
解答 解:(1)中和热的测定过程中,需要大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、量筒、环形玻璃搅拌棒和温度计,根据所给的仪器,可知还缺少的玻璃仪器为:环形玻璃搅拌棒和温度计;
故答案为:环形玻璃搅拌棒、温度计;
(2)稀盐酸和稀氢氧化钠溶液反应的中和热△H=-57.3kJ•mol-1,即HCl和NaOH反应生成1mol水放出57.3kJ的热量,表示中和热的热化学方程式为:HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1
故答案为:HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1;
(3)强酸与强碱的稀溶液发生中和反应热效应表示为:H+(aq)+OH-(aq)═H2O(l)△H=-57.3KJ•mol-1,若用稀醋酸、稀硫酸、浓硫酸分别和稀氢氧化钠溶液反应来测定中和热,因浓硫酸溶于水放热,醋酸的电离吸热,则恰好完全反应时的放出的热量为:①<②<③,所以△H1>△H2>△H3;
故答案为:△H1>△H2>△H3;
(4)3次温度差分别为:3.2℃,3.1℃,3.3℃,均有效,三次温度差平均值=$\frac{3.2℃+3.1℃+3.3℃}{3}$=3.2℃;
50mL 0.55mol/L NaOH溶液和50mL 0.5mol/L盐酸溶液进行中和反应生成水的物质的量为0.05L×0.5mol/L=0.025mol,溶液的质量为:100ml×1g/cm3=100g,温度变化的值为△T=3.2℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.2℃=1337.6J,即1.3376KJ,所以实验测得的中和热△H=$\frac{1.3376kJ}{0.025mol}$=-53.5kJ/mol;
故答案为:3.2;-53.5kJ/mol.
点评 本题考查了中和热的测定、误差分析,题目难度不大,注意掌握测定中和热的正确方法,明确实验操作过程中关键在于尽可能减少热量散失,使测定结果更加准确.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
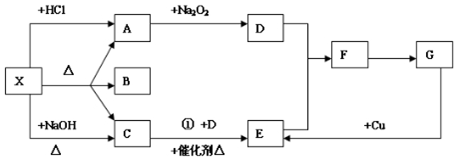
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
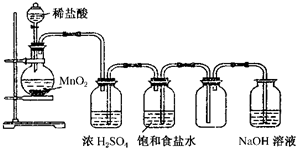 如图所示是某学生设计的实验室制备干燥Cl2及吸收多余Cl2的实验装置图,根据图中的装置和有关试剂回答下列问题.
如图所示是某学生设计的实验室制备干燥Cl2及吸收多余Cl2的实验装置图,根据图中的装置和有关试剂回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
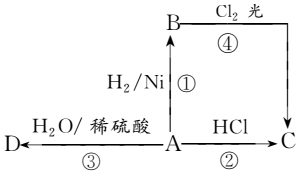 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃煤中加入CaO后可减少酸雨的发生气体的排放 | |
| B. | 纤维素、蛋白质、油脂都是天然有机高分子化合物 | |
| C. | 纤维素在人体内可水解为葡萄糖,是人类重要的营养物质之一 | |
| D. | 明矾是一种水处理剂,可用于水的杀菌、消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com