

| A. | 在0~a范围内,只发生中和反应 | |
| B. | ab段发生反应的离子方程式为CO32-+2H+═H2O+CO2 | |
| C. | 原混合溶液中NaOH和Na2CO3的物质的量浓度之比为2:1 | |
| D. | c点对应的溶液中还能大量存在Fe2+、NO3-离子 |
分析 对NaOH和Na2CO3混合配成的溶液,当滴加盐酸时,先发生氢氧化钠与盐酸的中和反应,再发生碳酸钠与盐酸的反应生成碳酸氢钠和氯化钠,最后发生碳酸氢钠与盐酸反应才有二氧化碳气体生成,利用物质的量的关系并结合图象即可解答.
解答 解:A、向NaOH和Na2CO3混合溶液中滴加盐酸时,首先和NaOH反应生成水和氯化钠,NaOH+HCl=NaCl+H2O,继续滴加时,盐酸和Na2CO3开始反应,首先发生HCl+Na2CO3=NaHCO3+NaCl,不放出气体,所以不只是酸碱中和反应,还有盐与酸反应,故A错误;
B、ab段发生反应为:NaHCO3+HCl=NaCl+H2O+CO2↑,反应的离子方程式为:HCO3-+H+=H2O+CO2↑,故B错误;
C、根据碳元素守恒,混合物中,碳酸钠的物质的量是0.01mol,所以两步反应:HCl+Na2CO3=NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑,分别消耗的盐酸的量是0.01mol,0.1mol•L-1稀盐酸的体积分别是0.1L,所以a=0.3,则原混合溶液中NaOH与Na2CO3的物质的量分别是0.02mol和0.01mol,物质的量之比为2:1,故C正确;
D、c点对应的溶液是酸过量,而在酸性溶液中Fe2+、NO3-离子要发生氧化还原反应,而不能大量共存,故D错误;
故选C.
点评 此题考查了元素化合物、图象数据的处理知识,解答此题的易错点是,不能准确理解向碳酸钠溶液中滴加盐酸的反应.是分步进行的,首先发生的是HCl+Na2CO3=NaHCO3+NaCl;进行完全后,再发生:NaHCO3+HCl=NaCl+H2O+CO2↑.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 3Cl2+6NaOH$\frac{\underline{\;△\;}}{\;}$5NaCl+NaClO3+3H2O | |
| B. | Fe+CuSO4=FeSO4+Cu | |
| C. | Cu+2H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$CuSO4+SO2↑+2H2O | |
| D. | 2Na+2HCl═2NaCl+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②③④ | C. | ①④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
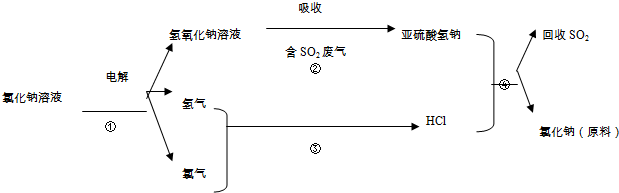
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
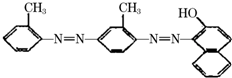 据中央电视台每周质量报告报道.北京市场上销售的一部分标称是白洋淀特产的“红心鸭蛋”含偶氮染料“苏丹红Ⅳ号”,国际癌症研究机构将其列为三类致癌物.“苏丹红Ⅳ号”的结构简式如图.下列关于“苏丹红Ⅳ号”说法正确的是( )
据中央电视台每周质量报告报道.北京市场上销售的一部分标称是白洋淀特产的“红心鸭蛋”含偶氮染料“苏丹红Ⅳ号”,国际癌症研究机构将其列为三类致癌物.“苏丹红Ⅳ号”的结构简式如图.下列关于“苏丹红Ⅳ号”说法正确的是( )| A. | 属于芳香烃 | B. | 属于苯的同系物 | C. | 属于氨基酸 | D. | 能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
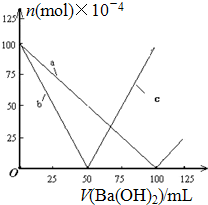
| A. | 曲线a表示Ba2+的物质的量的变化 | |
| B. | 曲线c表示OH-的物质的量的变化 | |
| C. | 加入Ba(OH)2溶液50mL时反应的离子方程式为:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 加入Ba(OH)2溶液大于50mL后,反应的离子方程式为:OH-+H+═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制作印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 用石墨棒作电极电解CuCl2溶液:Cu2++2Cl-$\frac{\underline{\;通电\;}}{\;}$ Cu+Cl2↑ | |
| C. | 硫酸铝溶液与过量氢氧化钠溶液反应的离子方程式:Al3++3OH-═Al(OH)3↓ | |
| D. | 用醋酸巧除水垢的反应:CaC03+2H+═Ca2++C02↑+H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
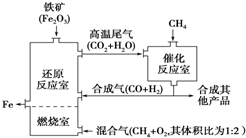
| A. | 加入铁矿石时,将铁矿石粉碎,目的是加快反应速率提高原料利用率 | |
| B. | 增大催化反应室的压强,甲烷的转化率增大 | |
| C. | 设置燃烧室的目的是产生CO2和水蒸气作原料气与甲烷反应 | |
| D. | 催化反应室需维持在550~750℃,目的仅是提高CH4转化的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O3是氧的一种同位素,其中含有共价键,属于共价化合物 | |
| B. | NaOH、HNO3中都含有离子键和共价键 | |
| C. | 235U、238U是两种不同核素,属于同一种元素 | |
| D. | 已知石墨合成金刚石是吸热反应,金刚石比石墨稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com