
分析 (1)硅不与盐酸反应,只有镁与盐酸反应生成氯化镁和氢气,根据n=$\frac{V}{{V}_{m}}$计算出氢气的物质的量,再根据反应方程式计算出消耗氯化氢的物质的量;
(2)根据(1)可知镁的物质的量,根据m=nM计算出镁的质量,从而得出硅的质量.
解答 解:(1)硅不与盐酸反应,只有镁与盐酸反应生成氯化镁和氢气,
标况下0.672L氢气的物质的量为:$\frac{0.672L}{22.4L/mol}$=0.03mol,根据反应Mg+2HCl═MgCl2+H2↑可知,反应消耗盐酸的物质的量为:0.03mol×2=0.06mol,
答:反应中消耗氯化氢的物质的量为0.06mol;
(2)根据反应Mg+2HCl═MgCl2+H2↑可知,生成0.03mol氢气需要消耗0.03molMg,则Mg 的质量为:24g/mol×0.03mol=0.72g,
则混合金属中硅的质量为:1.1g-0.72g=0.38g,
答:该混合物中含有0.72g镁,0.38g硅.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应原理为解答关键,注意熟练掌握物质的量与摩尔质量、气体摩尔体积等物理量之间的关系,试题培养了学生的分析能力及化学计算能力.


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:多选题
| A. | Cu和Al | B. | Mg和Al | C. | Al和 Zn | D. | Mg 和 Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若Y元素形成的单质是气体,则X元素形成的单质一定也是气体 | |
| B. | 若HnXOm为强酸,则X的氢化物溶液于水一定显酸性 | |
| C. | 若X、Y原子序数相差1,Y为ⅡA族,则X一定是ⅢA族 | |
| D. | 若Y(OH)m易溶于水,则X(OH)n一定不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
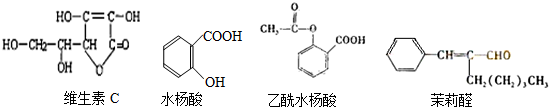
| A. | 水杨酸和茉莉醛均能发生银镜反应 | |
| B. | 乙酰水杨酸可以由水杨酸发生酯化反应生成 | |
| C. | 四种有机物都含有碳碳双键,都能和氢气发生加成反应 | |
| D. | 四种机物中只有乙酰水杨酸能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
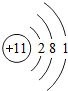 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙 | 丙 | 丁 | |
| 甲 | 戊 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9:11 | B. | 11:9 | C. | 3:11 | D. | 27:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
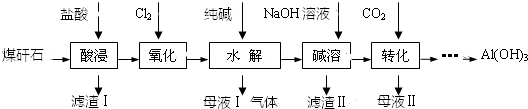
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常条件下,化学性质非常不活泼 | |
| B. | 其原子与同周期ⅥA、ⅦA族元素形成的阴离子具有相同的核外电子排布 | |
| C. | 原子的最外电子层都有8个电子 | |
| D. | 原子核外电子的排布都达到了稳定结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com