


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3-OH- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
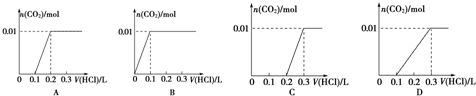
| 1 |
| 2 |
 ;△H1
;△H1查看答案和解析>>
科目:高中化学 来源: 题型:
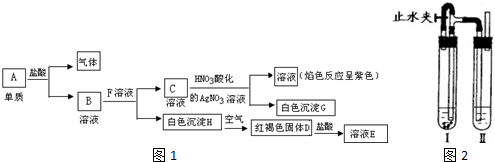
| A、向粗盐溶液中滴加盐酸和BaCl2溶液,产生白色沉淀,则说明粗盐中含有SO42- |
| B、向精盐溶液中滴加盐酸和BaCl2溶液,无明显现象,则说明精盐中不含SO42- |
| C、向蒸馏水中滴加稀HNO3和AgNO3溶液,产生白色沉淀,则说明蒸馏水中含有Cl- |
| D、向自来水中滴加稀HNO3和AgNO3溶液,产生白色沉淀,则说明自来水中含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | 2- 7 |
| O | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O2 |
| ① |
| O2 |
| ② |
| H2O |
| ③ |
| A、若X为N2或NH3,则A为硝酸 |
| B、若X为S或H2S,则A为硫酸 |
| C、若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y |
| D、反应①和一定为氧化还原反应,反应一定为非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同位素示踪法是科学家经常使用的研究化学反应历程的手段之一 |
| B、乙烷在1H核磁共振谱中只会在一个位置上出现特征峰 |
| C、红外光谱能够快速、微量、精确的测定相对分子质量 |
| D、“基团理论”认为有机化学中的“基”是一成不变的,这种说法是不正确的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、热稳定性:Na2CO3>NaHCO3 |
| B、常温时在水中的溶解度:NaHCO3>Na2CO3 |
| C、与稀盐酸反应的剧烈程度:Na2CO3>NaHCO3 |
| D、等质量的固体与足量盐酸反应放出CO2的质量:Na2CO3>NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、483.6 kJ |
| B、88 kJ |
| C、285.8 kJ |
| D、44 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com