
【题目】在一密闭容器中充入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表。
测定时刻/s | t1 | t2 | t3 | t4 |
c(A)/(mol·L-1) | 6 | 3 | 2 | 2 |
c(B)/(mol·L-1) | 5 | 3.5 | 3 | 3 |
c(C)/(mol·L-1) | 1 | 2.5 | 3 | 3 |
据此判断下列结论正确的是( )
A.在t3时刻反应已经停止
B.t1~t4时刻,A的转化率比B的转化率低
C.在容器中发生的反应为2A+B![]() 2C
2C
D.增大压强,达平衡时混合气体的平均相对分子质量增大
【答案】D
【解析】
t3-t4,各组分的浓度不再变化,且都不为0,
A、t3~t4时刻,各组分的浓度不再变化,且都不为0,说明该反应是可逆反应,且在t3时刻已经达到平衡状态,并非停止反应,A错误;
B、t1~t4时刻,α(A)=![]() =66.7%,α(B)=
=66.7%,α(B)=![]() =60%,则A的转化率比B的转化率高,B错误;
=60%,则A的转化率比B的转化率高,B错误;
C、t1~t3时刻,△c(A)=6mol·L-1-4mol·L-1=4mol·L-1,△c(B)=5mol·L-1-3mol·L-1=2mol·L-1,△c(C)=3mol·L-1-1mol·L-1=2mol·L-1,故该反应为2A(g)+B(g)![]() C(g),C错误;
C(g),C错误;
D、该反应为2A(g)+B(g)![]() C(g),增大压强,平衡正向移动,则体系的总物质的量减少,总质量不变,故混合气体的平均相对分子质量增大,D正确;
C(g),增大压强,平衡正向移动,则体系的总物质的量减少,总质量不变,故混合气体的平均相对分子质量增大,D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】根据如图所示示意图,下列说法不正确的是
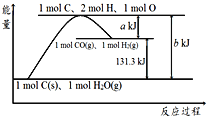
A. 反应的热化学方程式可表示为C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
B. 该反应过程反应物断键吸收的能量大于生成物成键放出的能量
C. a mol C和a mol H2O反应生成a mol CO和a mol H2吸收的热量一定为131.3a kJ
D. 1 mol C(g)、2 mol H、1 mol O转变成1 mol CO(g)和1 mol H2(g)放出的热量为a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验过程如图所示:则图③的试管中的现象是
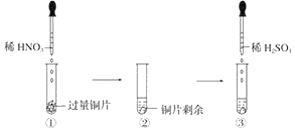
A. 无明显现象,因稀硫酸不与铜反应
B. 铜片溶解,产生无色气体,该气体遇到空气不变色
C. 铜片溶解,放出红棕色有刺激性气味的气体
D. 铜片溶解,产生无色气体,该气体在试管口变为红棕色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
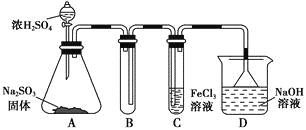
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在________中,再加水稀释,这样操作的目的是________,操作中不需要的仪器有________(填入正确选项前的字母)。
a.药匙 b.烧杯 c.石棉网 d.玻璃棒 e.坩埚
(2)通入足量SO2时,C中观察到的现象为______________________________。
(3)根据以上现象,该小组同学认为SO2与FeCl3溶液发生了氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式:___________________________;
②请设计实验方案检验有Fe2+生成:__________________________________;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-。该做法________(填“合理”或“不合理”),理由是_______________________________________________________________。
(4)D装置中倒置漏斗的作用是______________________________________。
(5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填入正确选项前的字母)。
a.浓H2SO4b.酸性KMnO4溶液
c.碘水 d.NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,装置Ⅰ为新型电池,放电时B电极的反应式为NaBr3+2Na++2e-=3NaBr,装置Ⅱ为铅蓄电池。首先闭合K1和K2,当铅蓄电池充电结束后,断开K1,闭合K2。下列说法正确的是

A.装置Ⅰ放电时的A电极反应式为2Na2S2-2e-=Na2S4+2Na+
B.闭合K1、K2时,每有0.1molNa+通过离子交换膜,装置Ⅱ溶液中有0.1mol电子转移
C.断开K1、闭合K2时,b电极的电极反应式为PbO2+2e-+SO42-+4H+=PbSO4+2H2O
D.断开K1、闭合K2时,装置Ⅱ中SO42-向a电极迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化氧磷(POCl3)是一种重要的化工原料,常用作半导体掺杂剂,实验室制取POCl3并测定产品含量的实验过程如下:
I.制备POCl3采用氧气氧化液态的PCl3法。实验装置(加热及夹持装置省略》及相关信息如下。

物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | ―112.0 | 76.0 | 137.5 | 均为无色液体,遇水均剧烈 水解为含氧酸和氯化氢,两者互溶 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)仪器a的名称为_______________________________;
(2)装置C中生成POCl3的化学方程式为________________________________;
(3)实验中需控制通入O2的速率,对此采取的操作是_________________________________;
(4)装置B的作用除观察O2的流速之外,还有___________________________________;
(5)反应温度应控制在60~65℃,原因是__________________________________;
II.测定POCl3产品含量的实验步骤:
①实验I结束后,待三颈烧瓶中液体冷却到室温,准确称取16.725g POCl3产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00mL溶液
②取10.00mL溶液于锥形瓶中,加入10.00mL 3.5mol/L AgNO3标准溶液(Ag++Cl-=AgCl↓)
③加入少量硝基苯(硝基苯密度比水大,且难溶于水)
④以硫酸铁溶液为指示剂,用0.2mol/L KSCN溶液滴定过量的AgNO3溶液(Ag++SCN-=AgSCN↓),到达终点时共用去10.00mL KSCN溶液。
(6)达到终点时的现象是_________________________________________;
(7)测得产品中n(POCl3)= ___________________________;
(8)已知Ksp(AgCl)> Ksp(AgSCN),据此判断,若取消步骤③,滴定结果将_______。(填偏高,偏低,或不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中很多“规律”都有适用范围,下列根据有关“规律”推出的结论错误的有( )
序号 | 规律 | 结论 |
① | 活泼金属的氧化物为碱性氧化物 |
|
② | 酸与酸性氧化物不能发生反应 | 氢氟酸可以储存在玻璃试剂瓶中 |
③ | 较弱酸不能制取较强酸 | 氢硫酸不能制取硫酸 |
④ | 复分解反应均不是氧化还原反应 | 酸碱中和反应中没有电子的转移 |
A.①②③B.②③④C.①③④D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物HIn在水溶液中因存在以下电离平衡HIn(aq,红色) ![]() H+(aq)+ In-(aq,黄色)故可作酸碱指示剂。浓度为0.02mol/L的下列溶液:① 盐酸 ② 石灰水 ③ NaCl溶液 ④ NaHSO4溶液 ⑤ NaHCO3溶液 ⑥ 氨水,其中能使指示剂显红色的是
H+(aq)+ In-(aq,黄色)故可作酸碱指示剂。浓度为0.02mol/L的下列溶液:① 盐酸 ② 石灰水 ③ NaCl溶液 ④ NaHSO4溶液 ⑤ NaHCO3溶液 ⑥ 氨水,其中能使指示剂显红色的是
A. ④⑤B. ③⑤C. ①④D. ②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中有如下反应:aX(g)+bY(g)![]() nW(g)ΔH=Q某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如图曲线图:其中ω(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是( )
nW(g)ΔH=Q某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如图曲线图:其中ω(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是( )
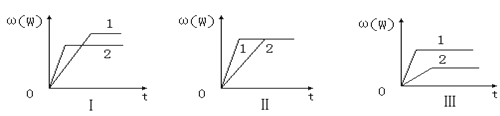
A.图Ⅱ可能是不同压强对反应的影响,且P1>P2,n<a+b
B.图Ⅲ可能是不同温度对反应的影响,且T1>T2,Q<0
C.图Ⅰ可能是不同压强对反应的影响,且P2>P1,a+b<n
D.图Ⅱ可能是在同温同压下催化剂对反应的影响,且2使用的催化剂效果好
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com