
| A、2px2表示2px能级有两个轨道 |
| B、在CS2分子中α键与π键的数目之比是2:1 |
| C、电子仅在激发态跃进到基态时才会产生原子光谱 |
| D、表示一个某原子在第三电子层上有10个电子可以写3s23p63d2 |


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化肥的合理使用,缓解了人类粮食危机 |
| B、绿色化学的快速发展,减轻了环境污染 |
| C、新材料的研制和应用,提高了人们的生活品质 |
| D、化石燃料的直接利用,促进了“低碳”经济的发展 |
查看答案和解析>>
科目:高中化学 来源: 题型:
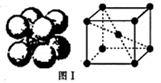 现有8种元素,它们的原子序数依次增大,其中A、B、C、D、E为短周期主族元素,F、G、H为第四周期元素.请根据下列相关信息,回答问题.
现有8种元素,它们的原子序数依次增大,其中A、B、C、D、E为短周期主族元素,F、G、H为第四周期元素.请根据下列相关信息,回答问题.| A是原子半径最小的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离分别是:I1=738kJ?mol-1 I2=1451kJ?mol-1 I3=7733kJ?mol-1 I4=10540kJ?mol-1 |
| D原子核外所有p轨道全充满或半充满 |
| E元素基态原子的核外电子排布为1s22s22p63s23p5 |
| F元素基态原子是前四周期中未成对电子数最多的元素 |
| G在周期表的第8列 |
| H元素原子价电子排布式为3d104s1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
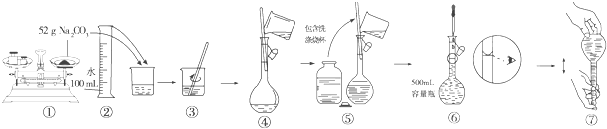
| A.吸收NH3,并防止倒吸用 | B.除去自来水中的Fe3+获得纯净水 | C.从KI和I2的固体混合物中回收I2 | D.苯提取溴水中的Br2 |
 |  |  |  |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若反应中转移的电子为nmol,则0.15<n<0.25 |
| B、n(Na+):n(Cl-)可能为7:3 |
| C、与NaOH反应的氯气一定为0.3mol |
| D、n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com