
 .
. .羰基硫(COS)分子结构与AB2分子结构相似,所有原子的最外层都满足8电子结构.用电子式表示羰基硫分子
.羰基硫(COS)分子结构与AB2分子结构相似,所有原子的最外层都满足8电子结构.用电子式表示羰基硫分子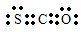 .
. 分析 A、B、C、D、E都是短周期元素,原子半径D>C>A>E>B,其中A、B处在同一周期,A、C处在同一主族,四种元素在周期表中的大致相对位置为: ,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,则B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,可推知A为碳元素,C为Si元素,D为Na元素,E的原子半径介于碳、氧之间,故E为N元素,据此解答.
,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,则B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,可推知A为碳元素,C为Si元素,D为Na元素,E的原子半径介于碳、氧之间,故E为N元素,据此解答.
解答 解:A、B、C、D、E都是短周期元素,原子半径D>C>A>E>B,其中A、B处在同一周期,A、C处在同一主族,四种元素在周期表中的大致相对位置为: ,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,则B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,可推知A为碳元素,C为Si元素,D为Na元素,E的原子半径介于碳、氧之间,故E为N元素.
,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,则B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,可推知A为碳元素,C为Si元素,D为Na元素,E的原子半径介于碳、氧之间,故E为N元素.
(1)C为Si元素,处于周期表中第三周期IVA族,故答案为:第三周期IVA族;
(2)氢化物稳定性与元素非金属性一致,由于非金属性O>N>C>Si,故氢化物稳定性:H2O>NH3>CH4>SiH4,故答案为:H2O>NH3>CH4>SiH4;
(3)E的氢化物为NH3,NH3分子间存在氢键,熔沸点比其同主族元素形成氢化物的熔沸点要高,
故答案为:NH3分子间存在氢键,使熔沸点升高;
(4)A与B形成的三原子分子为CO2,结构式是 O=C=O,B与D形成的原子个数比为1:1的化合物为Na2O2,电子式是 ,故答案为:O=C=O;
,故答案为:O=C=O; ;
;
(5)E的一种氢化物叫肼,其分子中E原子与氢原子个数比为1:2,则肼的分子式为N2H4,肼-空气燃料电池是一种环保碱性燃料电池,其电解质溶液是20%-30%的KOH溶液,原电池正极发生还原反应,氧气在正极获得电子,碱性条件下生成氢氧根离子,该燃料电池的正极的电极反应式是:O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-;
(6)用电子式表示Na2O的形成过程为 .羰基硫(COS)分子结构与CO2分子结构相似,所有原子的最外层都满足8电子结构,用电子式表示羰基硫分子 为:
.羰基硫(COS)分子结构与CO2分子结构相似,所有原子的最外层都满足8电子结构,用电子式表示羰基硫分子 为: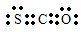 ,
,
故答案为: ;
;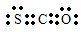 .
.
点评 本题考查元素位置结构性质的关系,侧重对化学用语及元素周期律的考查,题目难度中等,关键是正确推断元素的种类,注意根据原子位置关系及半径大小找出其在周期表中的相对位置.


科目:高中化学 来源: 题型:选择题
| A. | 金属间在溶液中发生置换反应 | |
| B. | 1 mol金属单质在反应中失去电子的多少 | |
| C. | 金属元素的最高价氧化物的水化物的碱性强弱 | |
| D. | 金属单质与水或酸置换出氢气的难易 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
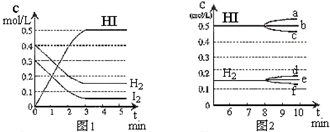 在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)?2HI(g)△H<0,反应中各物质的浓度随时间变化情况如图1:
在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)?2HI(g)△H<0,反应中各物质的浓度随时间变化情况如图1:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s22s22p63s23p64s2 | B. | 1s22s22p63s23p3 | ||
| C. | 1s22s22p63s23p2 | D. | 1s22s22p4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
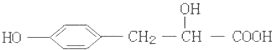
| A. | ①②③⑤⑥⑦ | B. | ②③④⑥⑧ | C. | ①②③④⑥ | D. | ③⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
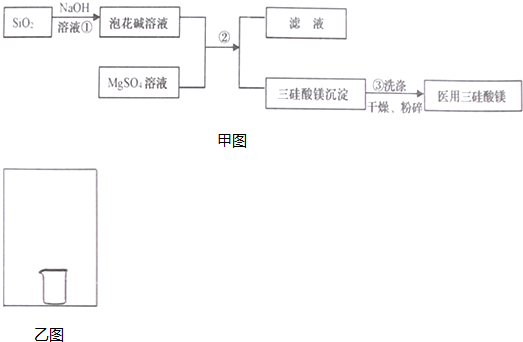
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com