
【题目】下列有关苯的说法错误的是( )
A.苯可以燃烧
B.苯分子的结构是平面正六边形
C.苯具有较强挥发性,有毒
D.苯的结构中含有碳碳双键,可以使溴水褪色
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】如图甲是一种利用微生物将废水中的尿素(H2NCONH2)直接转化为对环境友好物质的原电池装置。现利用甲装置产生的电能对乙装置中的饱和食盐水进行电解(A、B皆为石墨电极)。下列说法中不正确的是( )

①M电极反应式:H2NCONH2+H2O+6e-=CO2↑+N2↑+6H+
②当A电极产生11.2mL气体(标况)时,则N电极消耗25×10-4mol气体
③甲中H+透过质子交换膜由右向左移动
④A电极应与X相连接
⑤反应一段时间后,乙装置U型管中的溶液pH变大
A. ①③ B. ①③⑤ C. ①②③ D. ②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.2L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,对于该溶液成分。下列说法不正确的是( )

A. NaCl的物质的量为0.2mol
B. 溶质MgCl2的质量为9g
C. 该混合液中BaCl2的物质的量为0.1mol
D. 将该混合液加水稀释至体积为1L,稀释后溶液中Ba2+的物质的量浓度为0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是
A. K+、H+、SO![]() 、OH- B. Na+、Ca2+、CO
、OH- B. Na+、Ca2+、CO![]() 、NO
、NO![]()
C. Na+、H+、Cl-、CO![]() D. Na+、Cu2+、Cl-、SO
D. Na+、Cu2+、Cl-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)在图所示仪器中,配制上述溶液肯定不需要的是______(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是______.
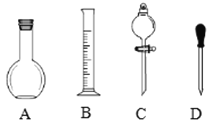
(2)在容量瓶的使用方法中,下列操作不正确的是______
A.使用容量瓶前检验是否漏水 |
B.容量瓶用水洗净后,再用待配溶液洗涤 |
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线. |
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线. |
E.盖好瓶塞,用食指顶住瓶塞,另一只手的手指托住瓶底,把容量瓶反复倒转多次,摇匀.
(3)根据计算用托盘天平称取NaOH固体的质量为______g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.1mol/L(填“大于”“小于”或“等于”).
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在正规化学试卷的开始处总有“可能用到的相对原子质量”一项,如H:1 C:12 Cl:35.5 S:32 Cu:64等.请问这些数值准确的说法应该是( )
A.某种核素的相对原子质量
B.某种核素的近似相对原子质量
C.某种元素的平均相对原子质量
D.某种元素的平均相对原子质量的近似值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以酸性氢氧燃料电池为电源进行电解的实验装置如图所示。下列说法正确的是( )
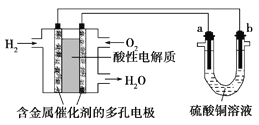
A. 燃料电池工作时,正极反应为O2+2H2O+4e-===4OH-
B. a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
C. 电解过程中SO42— 移向b极
D. a、b两极若是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在20℃时,在一容积不变的容器内部有一个不漏气且可滑动的活塞将容器分隔成左右两室。左室充入氮气,右室充入氢气与氧气的混合气体,活塞恰好停留在离左端的1/4处(如下图左所示),然后引燃氢、氧混合气体,反应完毕后恢复至原来温度,活塞恰好停在中间(如下图右所示),如果忽略水蒸气体积,则反应前氢气与氧气的体积比可能是
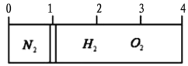

A. 3∶4 B. 4∶5 C. 6:2 D. 3∶7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R 为周期表前四周期原子序数依次增大的五种元素,X 与其他四种元素不同周期不同主族,M原子最外层2p轨道上有两个未成对电子,Y 易与M形成两种常见的化合物,R 在周期表的第9列。回答下列问题:
(1)R 基态原子M 能层的电子排布式为_________________,其原子核外共有_________种能量的电子。
(2)Y、M均可与X形成18e-的分子,其中属于极性分子的为_____________(填化学式),分子中Y、M 两种原子杂化方式依次为___________、_________________。
(3)Z 与M可形成的两种常见酸根离子的几何构型为__________、____________。
(4)R可形成原子簇化合物R2(CO)8,其沸点为52℃,不溶于水,易溶于乙醇、苯、二硫化碳等,是一种重要的有机合成催化剂,其结构如图,则该化合物属于_________晶体,该晶体中存在的作用力有___________(填标号)。
a.离子键 b.配位键 Cσ键 d.π键 e.氢键 f.范德华力
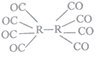
(5)单质R的晶胞有两种:417℃以下的晶胞结构如图1,417℃以上的晶胞结构如图2,后者配位数是_____________。若前者晶胞参数为ɑpm和c pm,单质R的摩尔质量为Mg·mol-1,阿伏加德罗常数为NA,则前者晶体密度p=_________g·cm-3(列出计算式即可)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com