
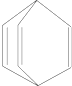
| A. | 桶烯在一定条件下能发生加聚反应 | |
| B. | 桶烯与苯乙烯(C6H5CH═CH2)互为同分异构体 | |
| C. | 桶烯中的一个氢原子被氯原子取代,所得产物只有两种 | |
| D. | 桶烯分子中所有的原子在同一平面上 |
分析 A.桶烯中含有碳碳双键,具有烯烃性质;
B.分子式相同、结构不同的有机物互称同分异构体;
C.桶烯中氢原子种类为2;
D.顶点上碳原子相当于甲烷中的碳原子,根据甲烷结构判断桶烯结构.
解答 解:A.桶烯中含有碳碳双键,具有烯烃性质,一定条件下能发生加聚反应,故A正确;
B.苯乙烯和桶烯分子式都是C8H8,结构不同,所以属于同分异构体,故B正确;
C.桶烯中氢原子种类为2,所以桶烯中的一个氢原子被氯原子取代,所得产物只有两种,故C正确;
D.顶点上碳原子相当于甲烷中的碳原子,甲烷中所有原子不共面,所以桶烯中不是所有原子共面,
故D错误;
故选D.
点评 本题考查有机物结构和性质,侧重考查分析分析判断及空间想象能力、知识迁移能力,明确官能团及其性质关系是解本题关键,D利用知识迁移方法判断原子是否共面,为易错点.


科目:高中化学 来源: 题型:选择题
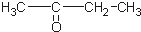 )、丙酮(
)、丙酮(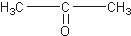 )和琥珀酸(
)和琥珀酸( )三者的混合物,该烃的结构简式为( )
)三者的混合物,该烃的结构简式为( )| A. | 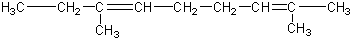 | |
| B. | 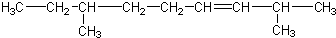 | |
| C. | 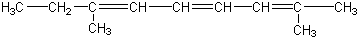 | |
| D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随着元素原子序数的递增,原子最外层电子总是从1到8重复出现 | |
| B. | 随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现 | |
| C. | 随着元素原子序数的递增,原子半径从小到大(稀有气体除外)发生周期性变化 | |
| D. | 元素原子的核外电子排布、原子半径及元素主要化合价的都发生周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应一定能自发的进行 | |
| B. | SO2能使品红溶液和溴水褪色,说明SO2具有漂白性 | |
| C. | 将AlCl3溶液和Al2(SO4)3溶液分别蒸干灼烧,所得产物的成分均为Al2O3 | |
| D. | 由反应AgCl(s)+KI(aq)?AgI(s)+KCl(aq)可知Ksp(AgCl)>Ksp(AgI) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $→_{H_{2}SO_{4}}^{KMnO_{4}}$
$→_{H_{2}SO_{4}}^{KMnO_{4}}$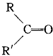 +
+
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
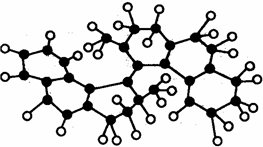 世界上最小的“马达”,只有千万分之一个蚊子那么大,其球棍模型如图(其中小黑球代表碳原子,小白球代表氢原子),它仅有碳氢两种元素组成,将来可用于消除体内垃圾. 该“马达”可能具有的性质是( )
世界上最小的“马达”,只有千万分之一个蚊子那么大,其球棍模型如图(其中小黑球代表碳原子,小白球代表氢原子),它仅有碳氢两种元素组成,将来可用于消除体内垃圾. 该“马达”可能具有的性质是( )| A. | 溶于水 | B. | 可以燃烧 | ||
| C. | 能和溴水发生取代反应 | D. | 能发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3 | |
| B. | 在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应 | |
| C. | 用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3 | |
| D. | 油脂在酸性或碱性条件下均可发生水解反应,且产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

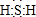 ;其水溶液长期在空气中放置容易变浑浊,用化学方程式表示该变化2H2S+O2 =2S↓+2H2O;该变化体现出硫元素的非金属性比氧元素弱(填“强”或“弱”).用原子结构解释原因氧和硫同主族,同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱.
;其水溶液长期在空气中放置容易变浑浊,用化学方程式表示该变化2H2S+O2 =2S↓+2H2O;该变化体现出硫元素的非金属性比氧元素弱(填“强”或“弱”).用原子结构解释原因氧和硫同主族,同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱. .该法吸收快,效率高.若在操作中持续通入含SO2的烟气,则最终产物为NaHSO3.室温下,0.1mol/L ①亚硫酸钠 ②亚硫酸氢钠 ③硫化钠 ④硫化氢钠的四种溶液的pH由大到小的顺序是③>①>④>②.(用编号表示)
.该法吸收快,效率高.若在操作中持续通入含SO2的烟气,则最终产物为NaHSO3.室温下,0.1mol/L ①亚硫酸钠 ②亚硫酸氢钠 ③硫化钠 ④硫化氢钠的四种溶液的pH由大到小的顺序是③>①>④>②.(用编号表示)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com