
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
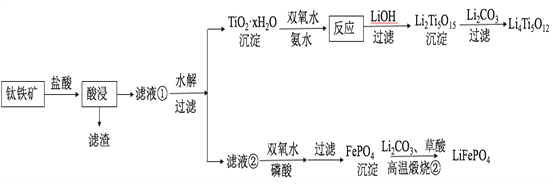
回答下列问题:
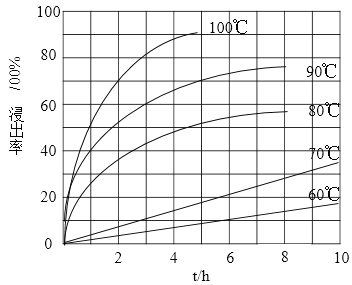
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
【答案】 100℃、2h,90℃,5h FeTiO3+ 4H++4Cl = Fe2++ TiOCl42 + 2H2O 低于40℃,TiO2·xH2O转化反应速率随温度升高而增加;超过40℃,双氧水分解与氨气逸出导致TiO2·xH2O转化反应速率下降 4 Fe3+恰好沉淀完全时,c(PO43-)= ![]() mol·L1=1.3×10-17 mol·L1,c3(Mg2+)×c2(PO43-)=(0.01)3×(1.3×10-17)2=1.7×10-40<Ksp [Mg3(PO4)2],因此不会生成Mg3(PO4)2沉淀。 2FePO4 + Li2CO3+ H2C2O4
mol·L1=1.3×10-17 mol·L1,c3(Mg2+)×c2(PO43-)=(0.01)3×(1.3×10-17)2=1.7×10-40<Ksp [Mg3(PO4)2],因此不会生成Mg3(PO4)2沉淀。 2FePO4 + Li2CO3+ H2C2O4![]() 2LiFePO4+ H2O↑+ 3CO2↑
2LiFePO4+ H2O↑+ 3CO2↑
【解析】(1)由图示可知,“酸浸”时铁的净出率为70%时所需要的时间最短,速率最快,则应选择在100℃、2h,90℃,5h下进行;
(2)“酸浸”时用盐酸溶解FeTiO3生成TiOCl42时,发生反应的离子方程式为FeTiO3+4H++4Cl=Fe2++ TiOCl42 + 2H2O;
(3)温度是影响速率的主要因素,但H2O2在高温下易分解、氨水易挥发,即原因是低于40℃,TiO2·xH2O转化反应速率随温度升高而增加;超过40℃,双氧水分解与氨气逸出导致TiO2·xH2O转化反应速率下降;
(4)Li2Ti5O15中Li为+1价,O为-2价,Ti为+4价,过氧根(O22-)中氧元素显-1价,设过氧键的数目为x,根据正负化合价代数和为0,可知(+1)×2+(+4)×5+(-2)×(15-2x)+(-1)×2x=0,解得:x=4;
(5)Ksp[FePO4]=c(Fe3+)×c(PO43-)=1.3×10-2,则c(PO43-)= =1.3×10-17mol/L,Qc[Mg3(PO4)2]=c3(Mg2+)×c2(PO43-)=(0.01)3×(1.3×10-17)2=1.69×10-40<1.0×10—34,则无沉淀。
=1.3×10-17mol/L,Qc[Mg3(PO4)2]=c3(Mg2+)×c2(PO43-)=(0.01)3×(1.3×10-17)2=1.69×10-40<1.0×10—34,则无沉淀。
(6)高温下FePO4与Li2CO3和H2C2O4混合加热可得LiFePO4,根据电子守恒和原子守恒可得此反应的化学方程式为2FePO4 + Li2CO3+ H2C2O4![]() 2LiFePO4+ H2O↑+ 3CO2↑。
2LiFePO4+ H2O↑+ 3CO2↑。


科目:高中化学 来源: 题型:
【题目】实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:
A.把制得的溶液小心地转移至容量瓶中。B.在天平上称出14.2g硫酸钠固体,把它放在烧杯中,用适量的蒸馏水使它完全溶解并冷却至室温。C.继续向容量瓶中加蒸馏水至液面距刻度1cm~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹面底部与刻度线相切。D.用少量蒸馏水洗烧杯和玻璃棒2—3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡。E.将容量瓶塞塞紧,充分摇匀。请填写下列空白:
(1)容量瓶上需标有以下五项中的___。
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(2)操作步骤的正确顺序为(填序号)___。
(3)本实验用到的基本仪器已有烧杯、量筒、天平(砝码、镊子)、玻璃棒,还缺少的仪器是___、___、___。
(4)下列情况会使所配溶液浓度偏高的是(填序号)___。
a.某同学观察液面的情况如图所示

b.没有进行上述的操作步骤D
c.加蒸馏水时,不慎超过了刻度线
d.砝码上沾有杂质
e.容量瓶用前内壁沾有水珠
(5)操作D的目的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活与健康,某地区的雾霾中可能含有如下离子中的若干种:NH4+、Ba2+、Fe2+、Cl-、NO3—、CO32—、SO42—。某同学收集了该地区的雾霾,经必要的预处理后得到试样溶液,设计并完成如下实验:
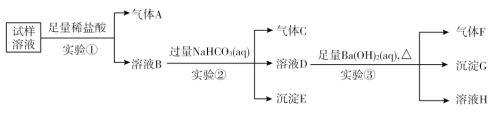
试回答下列问题:
(1)实验①中加入稀盐酸后,有气体A生成,溶液B依然澄清,且溶液中阴离子种类不变。据此可知原溶液中一定含有______________,一定不含______________。(填离子符号)
(2)实验①中发生反应的离子方程式为______________________________________。
(3)实验②中逐滴加入碳酸氢钠溶液,立即有气泡产生,反应的离子方程式为__________________,一段时间后又有沉淀出现,这时的离子方程式为____________。
(4)气体F的成分为________。(填化学式)
(5)根据实验③现象该同学认为原溶液中一定含有SO42—,有其他同学认为其结论不合理,又进行了后续实验④,最终确定原溶液中含有SO42—,试写出实验④可行的操作方法及现象_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,氧杂螺戊烷的结构简式为![]() ,则下列说法正确的是
,则下列说法正确的是
A. lmol该有机物完全燃烧需要消耗5.5molO2
B. 二氯代物超过3种
C. 该有机物与环氧乙烷互为同系物
D. 该有机物所有碳、氧原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )

A. a和b都属于芳香族化合物
B. a和c分子中所有碳原子均处于同一平面上
C. a、b和c均能使酸性KMnO4溶液褪色
D. b和c均能与新制的Cu(OH)2反应生成红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据反应回答下列问题:K2Cr2O7+14HCl=2KCl+2CrCl3+7H2O+3Cl2↑
①用双线桥法分析该氧化还原反应(标明得失电子及数目):__
K2Cr2O7+14HCl=2KCl+2CrCl3+7H2O+3Cl2↑
②以上反应中还原产物是__,氧化剂与还原剂的物质的量之比为___。
(2)写出下列化学反应的离子方程式:
①过氧化钠与水反应___。
②钠单质与水反应___。
③醋酸与氢氧化钾溶液反应___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。
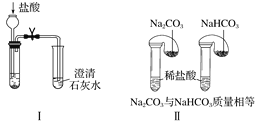
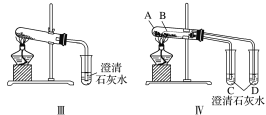
(1)图Ⅰ、Ⅱ所示实验中,__(填序号)能够较好达到实验目的。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,两个实验的发生装置中反应的化学方程式为:__;与实验Ⅲ相比,实验Ⅳ的优点是___(填字母)。
A.Ⅳ比Ⅲ复杂
B.Ⅳ比Ⅲ安全
C.Ⅳ比Ⅲ操作简便
D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是__(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安全气囊逐渐成为汽车的标配,因为汽车发生剧烈碰撞时,安全气囊中迅速发生反应:10NaN3+2KNO3![]() K2O+5Na2O+16N2↑,产生大量的气体使气囊迅速弹出,保障驾乘车人员安全。下列关于该反应的说法不正确的是
K2O+5Na2O+16N2↑,产生大量的气体使气囊迅速弹出,保障驾乘车人员安全。下列关于该反应的说法不正确的是
A. 该反应中NaN3是还原剂,KNO3是氧化剂
B. 氧化产物与还原产物的物质的量之比为15∶1
C. 若有50.5 g KNO3参加反应,则有1 mol N原子被还原
D. 每转移1 mol e,可生成标准状况下N2的体积为35.84 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人体中不可缺少的元素,为了预防碘缺乏,通常在精盐中添加一定的KIO3。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关资料,发现其检测原理是:KIO3 + 5KI + 3H2SO4 = 3I2 + 3K2SO4 + 3H2O
(1)用双线桥表示该反应中电子转移的方向和数目___________________________________,该反应中还原产物与氧化产物的质量之比是__________,0.2mol KIO3参加反应时,转移的电子为________mol。
(2)上面实验中用到一定物质的量浓度的稀硫酸,若配制1.0 mol/L的稀硫酸500mL,配制中需要用到的主要玻璃仪器有___________(填选项),需用18.0mol/L 浓硫酸_________mL。
a.100mL量筒 b.玻璃棒 c.100mL容量瓶 d.50mL量筒 e.胶头滴管
f.烧杯 g.500mL容量瓶
(3)下面操作造成所配稀硫酸溶液浓度偏高的有____________(填选项)。
a.溶解后溶液没有冷却到室温就转移;b.转移时没有洗涤烧杯、玻璃棒;c.转移过程中有少量液体流出;d.向容量瓶加水定容时眼睛俯视液面;e.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com