
| 容器 | 温度/k | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | 该反应的正反应放热 | |
| B. | 达到平衡时,容器I中反应物转化率比容器Ⅱ中的小 | |
| C. | 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中的两倍 | |
| D. | 达到平衡时,容器Ⅲ中的正反应速率比容器I中的大 |
分析 对比Ⅰ、Ⅲ,如温度相同,0.1mol/L的CH3OH相当于0.20mol/L的H2和0.1mol/L的CO,为等效平衡,但Ⅲ温度较高,平衡时CH3OH较低,说明升高温度平衡逆向移动,正反应为放热反应,对比Ⅰ、Ⅱ,在相同温度下反应,但Ⅱ浓度较大,由方程式可知,增大浓度,平衡正向移动,以此解答该题.
解答 解:A.对比Ⅰ、Ⅲ,如温度相同,0.1mol/L的CH3OH相当于0.20mol/L的H2和0.1mol/L的CO,为等效平衡,但Ⅲ温度较高,平衡时CH3OH较低,说明升高温度平衡逆向移动,正反应为放热反应,故A正确;
B.对比Ⅰ、Ⅱ,在相同温度下反应,但Ⅱ浓度较大,由方程式2H2(g)+CO(g)?CH3OH(g)可知,增大浓度,平衡正向移动,该反应正向为体积减小的反应,增大浓度转化率会增大,则容器Ⅰ中反应物转化率比容器Ⅱ中的小,故B错误;
C.Ⅱ浓度较大,Ⅲ温度较高,增大浓度平衡正向移动,升高温度平衡逆向移动,Ⅲ的转化率降低,Ⅲ中相当于起始C(H2)为Ⅱ的一半,平衡时Ⅱ中C(H2)小于Ⅲ中的两倍,故C错误;
D.对比Ⅰ、Ⅲ,Ⅲ温度较高,浓度相当,升高温度,正逆反应速率增大,则容器Ⅲ中的反应速率比容器Ⅰ中的大,故D正确.
故选AD.
点评 本题考查了化学平衡的有关计算、化学反应速率的影响,涉及等效平衡问题,侧重于学生的分析能力的考查,题目难度中等,答题时注意把握反应的特点以及平衡的影响因素.


科目:高中化学 来源: 题型:选择题
| A. | 糖类和蛋白质都属于高分子化合物 | B. | 苯和聚乙烯均能发生加成反应 | ||
| C. | C5H11Cl有6种同分异构体 | D. | 石油分馏、煤干馏都可得到烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔沸点:S<NaCl<SiO2 | |
| B. | 酸性:HNO2<HNO3;H3PO4<H2SO4 | |
| C. | 键角:H2O中H-O-H<NH3中H-N-H<CH4中H-C-H | |
| D. | 键长:C-H<O-H |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
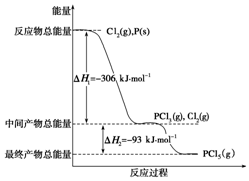 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-H | O-H | C=O | H-H |
| 吸收热量(kJ/mol) | 414 | 464 | 803 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | |||
| CO | H2O | CO2 | H2 | |||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S Cl 的原子半径依次减小 | |
| B. | Na Mg 的失电子能力依次增强 | |
| C. | O F的气态氢化物的稳定性依次增强 | |
| D. | Si P 的最高价含氧酸的酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
 ;所含化学键类型离子键、共价键.
;所含化学键类型离子键、共价键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com