
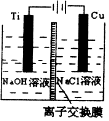
 ÄÉĆ×¼¶Cu2OÓÉÓŚ¾ßÓŠÓÅĮ¼µÄ“߻ƊŌÄܶųŹÜµ½¹Ų×¢£¬±ķĪŖÖĘČ”Cu2OµÄČżÖÖ·½·Ø£ŗ
ÄÉĆ×¼¶Cu2OÓÉÓŚ¾ßÓŠÓÅĮ¼µÄ“߻ƊŌÄܶųŹÜµ½¹Ų×¢£¬±ķĪŖÖĘČ”Cu2OµÄČżÖÖ·½·Ø£ŗ| ·½·Ø¢ń | ÓĆĢæ·ŪŌŚøßĪĀĢõ¼žĻĀ»¹ŌCuO |
| ·½·Ø¢ņ | µē½ā·Ø£ŗ2Cu+H2O$\frac{\underline{\;µē½ā\;}}{\;}$ Cu2O+H2”ü |
| ·½·Ø¢ó | ÓĆėĀ£ØN2H4£©»¹ŌŠĀÖĘCu£ØOH£©2 |
| ŠņŗÅ | 0 | 10 | 20 | 30 | 40 | 50 | |
| ¢Ł | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ¢Ś | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ¢Ū | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
·ÖĪö £Ø1£©ÓĆĢæ·ŪŌŚøßĪĀĢõ¼žĻĀ»¹ŌCuOČŻŅ×Éś³ÉCu£»
£Ø2£©øł¾ŻøĒĖ¹¶ØĀÉ£¬ÓÉŅŃÖŖČČ»Æѧ·½³ĢŹ½³ĖŅŌŹŹµ±µÄĻµŹż½ųŠŠ¼Ó¼õ¹¹ŌģÄæ±źČČ»Æѧ·½³ĢŹ½£¬·“Ó¦ČČŅ²³ĖŅŌĻąÓ¦µÄĻµŹż×÷ĻąÓ¦µÄ¼Ó¼õ£»
£Ø3£©Ńō¼«·¢ÉśŃõ»Æ·“Ó¦£¬¼īŠŌĢõ¼žĻĀCuŌŚŃō¼«Ź§Č„µē×ӵƵ½Cu2OÓėH2O£»
£Ø4£©ŅŗĢ¬ėĀ£ØN2H4£©»¹ŌŠĀÖĘCu£ØOH£©2Ą“ÖʱøÄÉĆ×¼¶Cu2O£¬Ķ¬Ź±·Å³öN2£¬øł¾ŻµĆŹ§µē×ÓŹŲŗć·ÖĪö£»
£Ø5£©A£®øł¾ŻĪĀ¶Č¶Ō»ÆŃ§Ę½ŗāŅĘ¶ÆµÄÓ°ĻģÖŖŹ¶Ą“»Ų“š£»
B£®øł¾Ż·“Ó¦ĖŁĀŹv=$\frac{”÷c}{”÷t}$Ą“¼ĘĖć£»
C£®“߻ƼĮ²»»įŅżĘš»ÆŃ§Ę½ŗāדĢ¬µÄøı䣬»įŹ¹·“Ó¦ĖŁĀŹ¼Óæģ£»
£Ø6£©¼ĘĖćČÜŅŗ»ģŗĻŗ󣬲»·¢Éś·“Ó¦Ź±c£ØAg+£©”¢c£ØCl-£©£¬ĮīĘ½ŗāŹ±ČÜŅŗÖŠAg+µÄÅضČĪŖxmol/L£¬øł¾Ż·“Ó¦Ag+£Øaq£©+Cl-£Øaq£©?AgCl£Øs£©£¬±ķŹ¾³öĘ½ŗāŹ±c£ØAg+£©”¢c£ØCl-£©£¬“śČėČܶȻż³£ŹżĮŠ·½³Ģ¼ĘĖć£»
ŌŁ¼ĘĖć»ģŗĻŗóČÜŅŗ£¬²»·¢Éś·“Ó¦Ź±c£ØAg+£©”¢c£ØCl-£©£¬¼ĘĖćĄė×ÓÅØ¶Č»ż£¬ÓėČܶȻż±Č½Ļ£¬ÅŠ¶ĻŹĒ·ń²śÉś³Įµķ£®
½ā“š ½ā£ŗ£Ø1£©ÓĆĢæ·ŪŌŚøßĪĀĢõ¼žĻĀ»¹ŌCuOČŻŅ×Éś³ÉCu£¬·“Ó¦²»Ņ×æŲÖĘÉś³ÉCu2O£»
¹Ź“š°øĪŖ£ŗ·“Ó¦²»Ņ×æŲÖĘ£¬Ņ×»¹Ō²śÉśCu£»
£Ø2£©¢Ł2Cu£Øs£©+$\frac{1}{2}$O2£Øg£©=Cu2O£Øs£©”÷H=-akJ•mol-1£¬
¢ŚC£Øs£©+$\frac{1}{2}$O2£Øg£©=CO£Øg£©”÷H=-bkJ•mol-1£¬
¢ŪCu£Øs£©+$\frac{1}{2}$O2£Øg£©=CuO£Øs£©”÷H=-ckJ•mol-1
ÓÉøĒĖ¹¶ØĀÉæÉÖŖ£¬¢Ł-¢Ū”Į2+¢ŚµĆ2CuO£Øs£©+C£Øs£©=Cu2O£Øs£©+CO£Øg£©”÷H=2c-a-bkJ•mol-1£»
¹Ź“š°øĪŖ£ŗ2c-a-b£»
£Ø3£©Ńō¼«·¢ÉśŃõ»Æ·“Ó¦£¬¼īŠŌĢõ¼žĻĀCuŌŚŃō¼«Ź§Č„µē×ӵƵ½Cu2OÓėH2O£¬Ńō¼«µē¼«·“Ó¦Ź½ĪŖ£ŗ2Cu-2e-+2OH-=Cu2O+H2O£¬
¹Ź“š°øĪŖ£ŗ2Cu-2e-+2OH-=Cu2O+H2O£»
£Ø4£©ŅŗĢ¬ėĀ£ØN2H4£©»¹ŌŠĀÖĘCu£ØOH£©2Ą“ÖʱøÄÉĆ×¼¶Cu2O£¬Ķ¬Ź±·Å³öN2£¬Ęä·“Ó¦µÄ·½³ĢŹ½ĪŖ£ŗ4Cu£ØOH£©2+N2H4$\frac{\underline{\;\;”÷\;\;}}{\;}$2Cu2O+N2”ü+6H2O£»
¹Ź“š°øĪŖ£ŗ4Cu£ØOH£©2+N2H4$\frac{\underline{\;\;”÷\;\;}}{\;}$2Cu2O+N2”ü+6H2O£»
£Ø5£©A”¢ŹµŃéĪĀ¶ČŌ½øߣ¬“ļµ½»ÆŃ§Ę½ŗāŹ±Ė®ÕōĘų×Ŗ»ÆĀŹŌ½“󣬢ŚŗĶ¢ŪĻą±Č£¬¢Ū×Ŗ»ÆĀŹøߣ¬ĖłŅŌT2£¾T1£¬¹ŹAÕżČ·£»
B”¢ŹµŃé¢ŁĒ°20minµÄĘ½¾ł·“Ó¦ĖŁĀŹ v£ØO2£©=$\frac{”÷c}{”÷t}$=$\frac{\frac{0.05mol/L-0.0486mol/L}{2}}{20min}$=3.5”Į10-5 mol•L-1 min-1£¬¹ŹB“ķĪó£»
C”¢¢Ł¢Ś»ÆŃ§Ę½ŗāדĢ¬Ī“øı䣬¢Ś·“Ó¦ĖŁĀŹ¼Óæģ£¬Ļȵ½“ļĘ½ŗā£¬ŌņŹµŃé¢Ś±ČŹµŃé¢ŁĖłÓĆµÄ“ß»Æ¼ĮŠ§ĀŹøߣ¬¹ŹCÕżČ·£®
¹ŹŃ”AC£»
£Ø6£©ČÜŅŗ»ģŗĻŗ󣬲»·¢Éś·“Ó¦Ź±c£ØAg+£©=$\frac{1”ä}{2}$”Į0.018mol•L-1=0.009mol•L-1”¢c£ØCl-£©=$\frac{1}{2}$”Į0.02mol•L-1=0.01mol•L-1£¬ĮīĘ½ŗāŹ±ČÜŅŗÖŠAg+µÄÅضČĪŖxmol/L£¬
Ag+£Øaq£©+Cl-£Øaq£©?AgCl£Øs£©
£Ø0.009-x£©mol/L £Ø0.009-x£©mol/L
·“Ó¦ŗóČÜŅŗÖŠc£ØCl-£©=0.01mol/L-£Ø0.009-x£©mol/L=£Ø0.001+x£©mol/L£¬¹Źx”Į£Ø0.001+x£©=1.8”Į10-10£¬ÓÉÓŚ0.009”Į0.01=9”Į10-5£¾1.8”Į10-10£¬¹Ź0.001+x”Ö0.001£¬½āµĆx”Ö1.8”Į10-7£¬
ŌŁĻņ·“Ó¦ŗóµÄČÜŅŗÖŠ¼ÓČė100mL0.001mol•L-1ŃĪĖį£¬²»·¢Éś·“Ó¦Ź±c£ØAg+£©=$\frac{1}{2}$”Į1.8”Į10-7mol•L-1=9”Į10-8mol•L-1”¢c£ØCl-£©=$\frac{1}{2}$”Į[£Ø0.001+1.8”Į10-7+0.001]mol•L-1”Ö0.001mol•L-1£¬¶ųĄė×ÓÅØ¶Č»ż=0.001”Į9”Į10-8=0.9”Į10-10£¼1.8”Į10-10£¬¹ŹĆ»ÓŠ³Įµķ²śÉś£¬
¹Ź“š°øĪŖ£ŗ1.8”Į10-7mol/L£»·ń£®
µćĘĄ ±¾Ģāæ¼²éøĒĖ¹¶ØĀɵÄÓ¦ÓĆ”¢µē½āŌĄķµÄÓ¦ÓĆ”¢Ńõ»Æ»¹Ō·“Ó¦·½³ĢŹ½µÄŹéŠ“ŗĶÅäĘ½”¢»Æѧ·“Ó¦ĖŁĀŹµÄ¼ĘĖćŅŌ¼°»ÆŃ§Ę½ŗāŅĘ¶Æ”¢Ę½ŗā³£Źż”¢ČܶȻżµÄÓ¦ÓĆµČ£¬ĢāÄæ×ŪŗĻŠŌ½Ļ“ó£¬ÄѶČÖŠµČ£¬ŹĒ¶ŌÖŖŹ¶µÄ×ŪŗĻŌĖÓĆ£¬×¢Ņā»ł“”ÖŖŹ¶µÄĄķ½āÕĘĪÕ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ×ö”°ÄĘÓėĖ®µÄ·“Ó¦”±ŹµŃ鏱£®ĒŠČ”ĀĢ¶¹“󊔵ĽšŹōÄĘ£¬ÓĆĀĖÖ½ĪüøɱķĆęĆŗÓĶ£¬·ÅČėÉÕ±ÖŠ£¬µĪČėĮ½µĪ·ÓĢŖČÜŅŗ£¬ŌŁ¼ÓČėÉŁĮæĖ®£¬Č»ŗó¹Ū²ģ²¢¼ĒĀ¼ŹµŃéĻÖĻó | |
| B£® | ½«KIŗĶFeCl3ČÜŅŗŌŚŹŌ¹ÜÖŠ»ģŗĻŗ󣬼ÓČėCCl4£¬Õńµ“£¬¾²ÖĆ£»ĻĀ²ćŅŗĢåĻŌ×ĻŗģÉ«£»ŌņŃõ»ÆŠŌ£ŗFe3+£¾I2 | |
| C£® | ²ā¶ØµČÅØ¶ČµÄNa2CO3ŗĶNa2SO3 ČÜŅŗµÄpH£»Ē°ÕßpH ±ČŗóÕߵēó£»Ōņ·Ē½šŹōŠŌ£ŗS£¾C | |
| D£® | äåŅŅĶéÓė NaOH ČÜŅŗ¹²ČČŗ󣬼ÓČėAgNO3ČÜŅŗ£»Ī“³öĻÖµ»ĘÉ«³Įµķ£»ĖµĆ÷äåŅŅĶéƻӊĖ®½ā |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
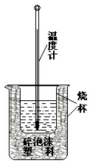 50ml 0.50mol•L-1ŃĪĖįÓė50mL 0.55mol•L-1NaOHČÜŅŗŌŚČēĻĀĶ¼ĖłŹ¾µÄ×°ÖĆÖŠ½ųŠŠÖŠŗĶ·“Ó¦£®Ķعż²ā¶Ø·“Ó¦¹ż³ĢÖŠ·Å³öµÄČČĮææɼĘĖćÖŠŗĶČČ£®»Ų“šĻĀĮŠĪŹĢā£ŗ
50ml 0.50mol•L-1ŃĪĖįÓė50mL 0.55mol•L-1NaOHČÜŅŗŌŚČēĻĀĶ¼ĖłŹ¾µÄ×°ÖĆÖŠ½ųŠŠÖŠŗĶ·“Ó¦£®Ķعż²ā¶Ø·“Ó¦¹ż³ĢÖŠ·Å³öµÄČČĮææɼĘĖćÖŠŗĶČČ£®»Ų“šĻĀĮŠĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
 50mL1.0mol/LŃĪĖįøś50mL1.1mol/LĒāŃõ»ÆÄĘČÜŅŗŌŚČēĶ¼ĖłŹ¾×°ÖĆÖŠ½ųŠŠÖŠŗĶ·“Ó¦£¬²¢Ķعż²ā¶Ø·“Ó¦¹ż³ĢÖŠĖł·Å³öµÄČČĮæĄ“¼ĘĖćÖŠŗĶČČ£®ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ
50mL1.0mol/LŃĪĖįøś50mL1.1mol/LĒāŃõ»ÆÄĘČÜŅŗŌŚČēĶ¼ĖłŹ¾×°ÖĆÖŠ½ųŠŠÖŠŗĶ·“Ó¦£¬²¢Ķعż²ā¶Ø·“Ó¦¹ż³ĢÖŠĖł·Å³öµÄČČĮæĄ“¼ĘĖćÖŠŗĶČČ£®ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ| ŹµŃéŠņŗÅ | ĘšŹ¼ĪĀ¶Čt1/”ę | ÖÕÖ¹ĪĀ¶Č£Øt2£©”ę | ĪĀ²ī£Øt2•t1£©”ę | ||
| ŃĪĖį | NaOHČÜŅŗ | Ę½¾łÖµ | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.7 | 6.7 |
| 2 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
| 3 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| Ö÷×å ÖÜĘŚ | ¢ńA | ¢ņA | ¢óA | ¢ōA | ¢õA | ¢öA | ¢÷A | 0 |
| ¶ž | ¢Ł | ¢Ś | ||||||
| Čż | ¢Ū | ¢Ü | ¢Ż | ¢Ž | ¢ß | ¢ą | ||
| ĖÄ | ¢į | ¢ā |
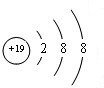
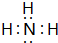 £»¢įµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļ
£»¢įµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļ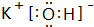 £»
£»²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | ŌŖĖŲC”¢D”¢EµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļÖ®¼äĮ½Į½¶¼æÉŅŌ·¢Éś·“Ó¦ | |
| B£® | 1molÓÉŌŖĖŲA”¢B×é³ÉĒŅŗ¬ÓŠ18 mol e-µÄ»ÆŗĻĪļÖ»ÓŠŅ»ÖÖ | |
| C£® | ŗ¬DŌŖĖŲµÄŃĪČÜŅŗÖ»ÄÜĻŌĖįŠŌ£¬²»æÉÄÜĻŌ¼īŠŌ | |
| D£® | »ÆŗĻĪļAEÓėCEŗ¬ÓŠĻąĶ¬ĄąŠĶµÄ»Æѧ¼ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
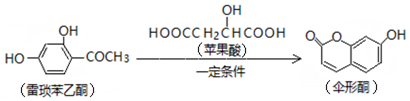
| A£® | Ņ»·Ö×ÓĄ×Ėö±½ŅŅĶŖŗ¬ÓŠ3øöĢ¼Ģ¼Ė«¼ü | |
| B£® | Ę»¹ūĖįµÄŅ»ÖÖĖõ¾Ū²śĪļŹĒ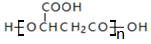 | |
| C£® | 1molÉ”ŠĪĶŖÓė×ćĮæNaOHČÜŅŗ·“Ó¦£¬×ī¶ąæÉĻūŗÄ2mol NaOH | |
| D£® | Ą×Ėö±½ŅŅĶŖ”¢Ę»¹ūĖį”¢É”ŠĪĶŖ¶¼ÄÜøśFeCl3ČÜŅŗ·¢ÉśĻŌÉ«·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com