
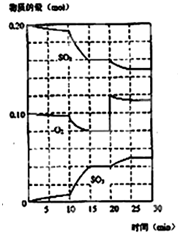
 ��һ�������£���������������������·�Ӧ��2SO2��g��+O2 ��g��?2SO3��g�� ����H��0��
��һ�������£���������������������·�Ӧ��2SO2��g��+O2 ��g��?2SO3��g�� ����H��0������ ��1��KΪ������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ�
��2���÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���
��3����ͼ��֪����Ӧ������20minʱ��������Ũ��ͻȻ����ƽ�������ƶ������������Ũ�ȼ�С�����������Ũ������
��4��10min��15min������б������Ӧ���ʼӿ죬�Դ������
��� �⣺��1����2SO2��g��+O2 ��g��?2SO3��g�� ��֪��K=$\frac{{c}^{2}��S{O}_{3}��}{{c}^{2}��S{O}_{2}��c��{O}_{2}��}$���ʴ�Ϊ��$\frac{{c}^{2}��S{O}_{3}��}{{c}^{2}��S{O}_{2}��c��{O}_{2}��}$��
��2���÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ������¶ȣ��÷�ӦKֵ����������ת�������ʴ�Ϊ����������
��3����ͼ��֪����Ӧ������20minʱ��������Ũ��ͻȻ����ƽ�������ƶ������������Ũ�ȼ�С�����������Ũ�����������߷����仯��ԭ����������������Ũ�ȣ���ͨ�����������ʴ�Ϊ��������������Ũ�ȣ���ͨ����������
��4��10min��15min������б������Ӧ���ʼӿ죬�Ӵ�������С����������ӿ췴Ӧ���ʣ������¶ȷ�Ӧ���ʼ�С��������SO3�����ʵ���ƽ�������ƶ�����Ӧ��Ũ��������ͼ�����ʴ�Ϊ��ab��
���� ���⿼�黯ѧƽ��ļ��㣬Ϊ��Ƶ���㣬����K�ı���ʽ��Ӱ�����ء�ƽ���ƶ�Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע��ͼ����ƽ���ƶ�ԭ���Ľ�ϣ���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
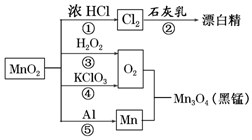
| A�� | ֻ�з�Ӧ�٢ڢ�����������ԭ��Ӧ | |
| B�� | ��Ӧ��˵���������������������۵�ϸߵĽ��� | |
| C�� | ��ͬ���������ɵ�����O2����Ӧ�ۺ͢�ת�Ƶĵ�����֮��Ϊ1��1 | |
| D�� | ��Ӧ�����������뻹ԭ�������ʵ���֮��Ϊ1��4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
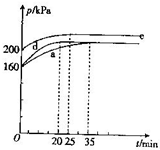 �ȼ��仯�������������������й㷺����;���ش��������⣺
�ȼ��仯�������������������й㷺����;���ش��������⣺| ������� | �¶�/ | �������/L | ClO2��g����ƽ��ת���� |
| a | T1 | V1=1L | 75% |
| b | T2 | V2 | |
| c | T3 | V3 | 75% |
| d | |||
| e |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ѹǿ �¶� | 1��105Pa | 5��105Pa | 10��105Pa | 50��105Pa | 100��105Pa |
| 450�� | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 500�� | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| t/�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
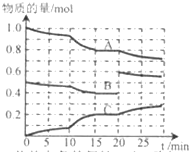 �ں㶨�¶�t�棬2L�����ܱ������з�����ӦaA��g��+bB��g��?cC��g����������A��B��C���ʵ����仯��ͼ��ʾ���ش��������⣺
�ں㶨�¶�t�棬2L�����ܱ������з�����ӦaA��g��+bB��g��?cC��g����������A��B��C���ʵ����仯��ͼ��ʾ���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na+��NO3-��Cl- | B�� | Cu2+��K+��NO3- | C�� | H+��HCO3-��NO3- | D�� | Na+��Ba2+��SO42- |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com