
【题目】锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意图如下:
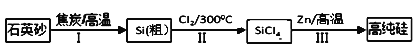
(1)1mol焦炭在过程Ⅰ中失去____mol电子。
(2)过程Ⅱ中Cl2用电解饱和食盐水制备,制备Cl2的离子方程式为________。
(3)步骤(2)中的电解过程中,若用甲醇燃料电池作电源,用KOH作电解质,负极反应为_________。
(4)整过生产过程必须严格控制无水,回答下列问题:
①SiCl4遇水剧烈水解生成SiO2和一种酸,化学反应方程式为_________。
②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中。冷却的作用是_________。
(5)Zn还原SiCl4的可逆反应如下:
SiCl4(g)+2Zn(s)![]() Si(S)+2ZnCl2(g)△H<0下列说法正确的是(___)
Si(S)+2ZnCl2(g)△H<0下列说法正确的是(___)
A.还原过程需在无氧的气氛中进行 |
B.投入1molZn可生成14g还原产物 |
C.增加SiCl4(g)的量,该反应平衡常数不变 |
D.若SiCl4(g)过量可增大△H的值 |
(6)有一种由硅制作的材料中常加入Ag2SO4 ,已知某温度下Ag2SO4(M=312g/mol)的溶解度为0.624g/100g H2O,该温度下Ag2SO4的Ksp=_______(两位有效数字)。
【答案】2 2Cl-+ 2H2O![]() Cl2↑ + H2↑ + 2OH- CH3OH一6e-+8OH- =CO32-+7H2O SiCl4+2H2O=SiO2+4HCl 使水蒸气冷凝,减少进入浓硫酸的水,保持浓硫酸持续的吸水性,同时降低放出的热量 AC 3.2×10-5
Cl2↑ + H2↑ + 2OH- CH3OH一6e-+8OH- =CO32-+7H2O SiCl4+2H2O=SiO2+4HCl 使水蒸气冷凝,减少进入浓硫酸的水,保持浓硫酸持续的吸水性,同时降低放出的热量 AC 3.2×10-5
【解析】
石英砂的主要成分是二氧化硅,用焦炭在高温下还原得到粗硅,和氯气反应生成液体SiCl4,分离出SiCl4后用锌在高温下还原得到高纯硅。
(1)焦炭与二氧化硅反应生成Si和CO,C元素的化合价升高2价,所以1mol焦炭参加反应,转移电子的物质的量是2mol;
(2)电解饱和食盐水生成氯气、氢气、氢氧化钠、离子方程式是2Cl-+ 2H2O![]() Cl2↑ + H2↑ + 2OH-;
Cl2↑ + H2↑ + 2OH-;
(3)若用甲醇燃料电池作电源,用KOH作电解质,则甲醇在负极发生氧化反应,因为电解质溶液为碱性,所以生成的二氧化碳与氢氧根离子反应生成碳酸根离子和水,则负极反应方程式是CH3OH一6e-+8OH- =CO32-+7H2O;
(4)①SiCl4遇水剧烈水解生成SiO2和一种酸,根据元素守恒,该酸为HCl,所以水解方程式是SiCl4+2H2O=SiO2+4HCl ;
②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,将约90℃的潮湿氯气先冷却至12℃,使水蒸气冷凝,减少进入浓硫酸的水,保持浓硫酸持续的吸水性,因为浓硫酸与水混合会放出大量的热,从操作安全着想,该操作还能降低放出的热量,降低安全隐患;
(5)A.Zn为活泼金属,易与空气中的氧气反应,所以还原过程需在无氧的气氛中进行 ,正确;B.该反应是可逆反应,投入1molZn不可能完全转化为生成物,所以生成还原产物的质量小于14g ,错误; C.温度不变,则平衡常数不变,所以增加SiCl4(g)的量,该反应平衡常数不变,正确; D.一个固定反应的反应热是固定值,不随反应物的用量而改变,错误,答案选AC;
(6)已知某温度下Ag2SO4(M=312g/mol)的溶解度为0.624g/100g H2O,则100g水中Ag2SO4的物质的量是0.624g/312g/mol=0.002mol,溶有0.002mol Ag2SO4的100g水的体积近似为0.1L,根据饱和溶液中存在Ag2SO4![]() 2Ag++SO42-,则硫酸根离子的浓度是0.002mol/0.1L=0.02mol/L,银离子的浓度是0.04mol/L,所以该温度下Ag2SO4的Ksp= 0.02×0.042=3.2×10-5。
2Ag++SO42-,则硫酸根离子的浓度是0.002mol/0.1L=0.02mol/L,银离子的浓度是0.04mol/L,所以该温度下Ag2SO4的Ksp= 0.02×0.042=3.2×10-5。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯。在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题。
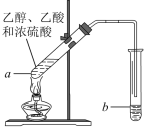
(1) 用化学方法可以鉴别乙醇和乙酸的试剂是______________(填字母);
a.稀硫酸 b.酸性KMnO4溶液
c.NaOH溶液 d.紫色的石蕊溶液
(2) 试管a中加入几块碎瓷片的目的是______________;
(3) 为了研究乙醇与乙酸反应的机理,若将乙醇中的氧原子用18O标记,写出标记后试管a中发生反应的化学方程式:_________________________________________ ;其反应类型是______________;
(4) 反应开始前,试管b中盛放的溶液是_____________ ;
(5) 反应结束后,常用____________操作把试管b中合成的酯分离出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、F是家庭中常见的有机物,E是石油化工发展水平的标志,F是一种常见的高分子材料。根据下面转化关系回答下列问题:

(1)操作⑥、操作⑦的名称分别为________、________。
(2)下列物质中沸点最高的是________。
A 汽油 B 煤油
C 柴油 D 重油
(3)在①~⑤中属于取代反应的是________;原子利用率为100%的反应是________。(填序号)
(4)写出结构简式:A________、F________。
(5)写出反应③的离子方程式:___________。
(6)作为家庭中常见的物质F,它给我们带来了极大的方便,同时也造成了环境污染,这种污染称为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图曲线表示其他条件一定时,2NO(g)+O2(g)![]() 2NO2(g) △H<0反应中NO2的百分含量与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )
2NO2(g) △H<0反应中NO2的百分含量与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )

A. a点B. b点C. c点D. d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中常用炼锌废渣(含有ZnO、FeO、Fe2O3、CuO等杂质)来提取氧化锌和金属铜等,其主要工艺流程如图所示:
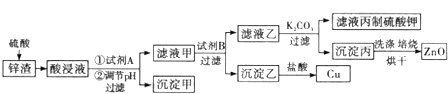
有关氢氧化物开始沉淀和沉淀完全的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 5.4 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 | 6.7 | 8.0 |
(1)为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有(写出两条) ______
(2)试剂A是 ______ (填化学式).
(3)调节酸浸液的pH的范围是 ______.
(4)滤液甲与试剂B发生置换反应,则试剂B是 ______ (填化学式).
(5)在实验室进行焙烧时,盛放沉淀丙的仪器名称是 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化铁(FeCl3)样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行,根据流程回答以下问题:
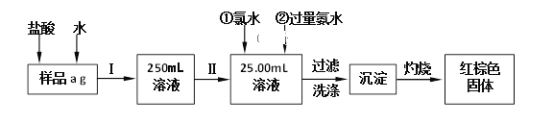
(1)操作I是配制溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有_______、_______。
(2)写出加入氯水发生的离子反应方程式________________________________。
(3)写出加入过量氨水发生的离子反应方程式_______________________________。
(4)写出灼烧发生反应的化学方程式_______________________________。
(5)检验沉淀是否已经洗涤干净的操作是______________________________。
(6)下列操作可能使所配溶液浓度偏小的是__________(填写序号)。
①未洗涤烧杯和玻璃棒
②定容时俯视容量瓶的刻度线
③配溶液前容量瓶中有少量蒸馏水
④摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
(7)若原样品质量a为10g,加热后红棕色固体质量是0.6g,则样品中铁元素的质量分数是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸的反应为S+2KNO3+3C![]() K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
A. 该反应中的还原剂为KNO3
B. 该反应中C被还原
C. 若消耗32g S,该反应转移电子数为2 NA
D. 若生成标准状况下气体22.4L,则有0.75 mol物质被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为五种常见的有机物,它们之间的转化关系如图1所示。其中A是一种可以使溴水及酸性![]() 溶液褪色的气体,可作为水果的催熟剂。D分子的模型如图2所示。
溶液褪色的气体,可作为水果的催熟剂。D分子的模型如图2所示。

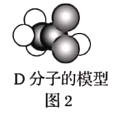
请回答下列问题:
(1)A的结构简式为_____,E中的官能团名称为______。
(2)由B生成C的反应类型是_____,由B生成E的反应类型是___。
(3)A反应生成B的化学方程式为____。
(4)B在一定条件下可以生成某种高分子化合物,该高分子化合物的链节是_____。
(5)C物质存在一种同分异构体,该同分异构体属于有毒的一类致癌物,其别名为恶烷,曾被广泛的用于洗涤,制药,印染等行业,试推测其结构简式_____。
(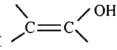 结构不稳定)
结构不稳定)
(6)C在![]() 条件下,借助催化剂与空气充分作用也可以转化成D,其转化的化方程式为_____。
条件下,借助催化剂与空气充分作用也可以转化成D,其转化的化方程式为_____。
(7)在实验室中取![]() 和
和![]() 在浓硫酸催化条件下得到
在浓硫酸催化条件下得到![]() ,试计算该反应产物的产率是______。(保留三位有效数字)
,试计算该反应产物的产率是______。(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱硫废水的主要超标项目为悬浮物、重金属阳离子(Hg2+、Cu2+等)、SO42-。某工厂采用如下流程进行脱硫废水处理。其中助凝剂为聚丙烯酰胺![]()
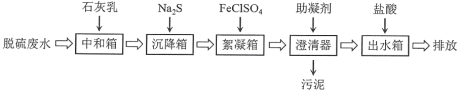
下列说法不正确的是
A.该方案用石灰乳仅用来调节pH使大部分重金属阳离子形成氢氧化物沉淀
B.加入Na2S可以将进入沉降箱的Hg2+,Cu2+转化为硫化物沉淀
C.加入FeClSO4是利用Fe3+易水解的性质,形成胶体吸附悬浮物
D.助凝剂聚丙烯酰胺是加成聚合反应的产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com