
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(E) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(E) | 0.50 | 0.30 | 0.18 | … | 0.15 |
| A. | 温度:T1<T2 | |
| B. | 平衡常数:K(T1)>K(T2) | |
| C. | T2温度下10min内,平均速率为v(E)=0.020mol•L-1•min-1 | |
| D. | T1温度下达到平衡后,再充入0.50mol E和1.0mol F,达到新平衡时E的浓度不变 |
分析 由表中数据可知,T1温度在40min到达平衡,开始对应各组分浓度相等,前20min内温度T2的反应速率大于温度T1的,则温度T2>T1,T2温度先到达平衡,到达平衡时间小于40min,50min处于平衡状态,此时E的物质的量为0.15mol,大于T1温度平衡时的0.1mol,说明平衡逆向移动,则正反应为放热反应,根据平衡移动原理知识来判断.
解答 解:A、由表中数据可知,T1温度在40min到达平衡,开始对应各组分浓度相等,前20min内温度T2的反应速率大于温度T1的,则温度T2>T1,故A错误;
B、T2温度先到达平衡,到达平衡时间小于40min,50min处于平衡状态,此时E的物质的量为0.15mol,大于T1温度平衡时的0.1mol,说明平衡逆向移动,则正反应为放热反应,温度越高,K越小,所以K(T1)>K(T2),故B正确;
C、T2温度下10min内,平均速率为v(E)=$\frac{\frac{0.5mol-0.3mol}{2L}}{10min}$=0.010mol•L-1•min-1,故C错误;
D、T1温度下达到平衡后,再充入0.50mol E和1.0mol F,会使得化学平衡正向移动,达到新平衡时E的浓度减小,故D错误.
故选B.
点评 本题考查化学平衡计算与影响因素,关键是根据E物质的量变化判断温度大小,侧重考查学生对数据的分析处理能力.


科目:高中化学 来源: 题型:选择题
| A. | 木炭在氧气中燃烧,发出白光,放出热量,产生能使澄清石灰水变浑浊的气体 | |
| B. | 细铁丝在空气里剧烈燃烧,火星四射,生成黑色固体物质 | |
| C. | 硫在氧气中燃烧,发出黄色火焰,生成无色有刺激性气味的气体 | |
| D. | 加热铜绿时,生成黑色氧化铜固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于3:8 | B. | 大于3:8 | C. | 小于或等于3:8 | D. | 大于3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片与盐酸反应生成氢气 | B. | 氢氧化铝溶于强碱溶液 | ||
| C. | 氢氧化铝溶于强酸溶液 | D. | 铝热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.15NA | B. | 0.6NA | C. | 1.2NA | D. | 2.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ③⑥ | C. | 只有② | D. | 只有⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
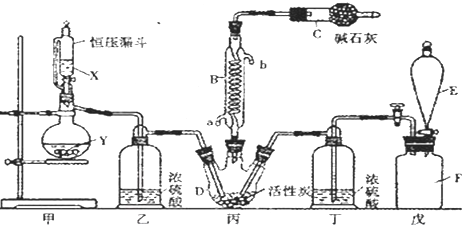
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
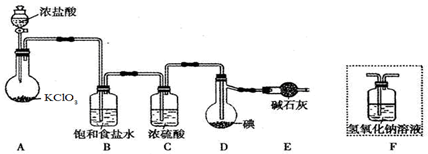
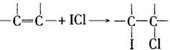
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com