
【题目】电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O, 则下列说法正确的是( )
2PbSO4+2H2O, 则下列说法正确的是( )
A. 放电时:当外电路通过1mol的电子时,理论上负极板的质量增加了151.5g
B. 充电时:阳极反应是PbSO4-2e-+2H2O = PbO2+SO42-+4H+
C. 放电时:正极反应是Pb-2e-+SO42-= PbSO4
D. 充电时:铅蓄电池的阴极应与电源的正极相连
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】(15分)Na2O2可用作漂白剂和呼吸面具中的供氧剂。
(1)某学习小组发现:在盛有Na2O2的试管中加入足量水,立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞试液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生。
①使酚酞试液变红是因为 ,红色褪去的可能原因是 。
②加入MnO2反应的化学方程式为 。
(2)Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应。为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下。
步骤1:按图示组装仪器(图中夹持仪器省略),检查气密性,装入药品;
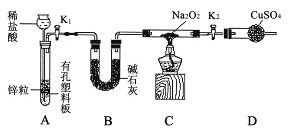
步骤2:打开K1、K2,产生的氢气流经装有Na2O2的硬质玻璃管,一段时间后,没有任何现象;
步骤3:检验H2的纯度后,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色;
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
①盛装稀盐酸的仪器名称 ;B装置的作用是 。
②必须检验氢气纯度的原因是 。
③设置装置D的目的是 。
④你得到的结论是 (若能反应请用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法适合实验室制取氨气的是( )
A. N2和H2催化加热制取氨气
B. 加热NH4Cl制取氨气
C. 将浓氨水向氧化钙固体上滴加
D. 将NH4Cl溶液和NaOH溶液混合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应3S+6KOH == K2SO3+ 2K2S +3H2O中,被氧化与被还原的硫原子数之比为( )
A. 1:2B. 2:1C. 1:1D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸(HNO2)在反应中既可作氧化剂,又可作还原剂。当它作还原剂时,其氧化产物可能是( )
A. NH3 B. N2
C. NO2 D. NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是探究发生腐蚀的装置图。发现开始时U形管左端红墨水水柱下降,一段时间后U形管左端红墨水水柱又上升。下列说法不正确的是

A. 两种腐蚀负极的电极反应式均为Fe-2e-=Fe2+
B. 开始时发生的是析氢腐蚀
C. 一段时间后发生的是吸氧腐蚀
D. 析氢反应的总反应式为2Fe+O2+2H2O=2Fe(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的数值,下列叙述中正确的是( )
A.常温常压下,48gO3含有的氧原子数为3NA
B.24g金属镁变为镁离子时失去的电子数为NA
C.4℃时9mL水和标准状况下11.2L氮气含有相同的原子数
D.同温同压下,NA个NO与NA个N2和O2的混合气体的体积不相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com