
【题目】下列叙述不正确的是
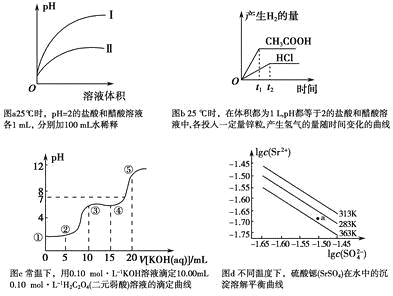
A.图a中,曲线Ⅱ表示醋酸溶液加100 mL水稀释的图像
B.图b中,可能各投入的锌粒颗粒大小相同且质量均为0.65 g
C.图c中,在①、②、③、④、⑤各点的溶液中所含阴离子种类不同
D.图d中,三个不同温度中,313 K时Ksp(SrSO4)最大;且283 K时,图中a点对应的溶液是不饱和溶液
【答案】C
【解析】
A.盐酸是强酸,完全电离,醋酸是弱酸,部分电离,相同温度下,相同pH值的盐酸和醋酸溶液,醋酸浓度大,溶液稀释时,醋酸进一步电离,其溶液中pH小于盐酸的pH,故Ⅱ应为醋酸稀释时的pH值变化曲线,故A正确;
B.1L、pH值等于2的盐酸溶液中c(H+)=0.01mol/L,n(H+)=0.01mol,1L、pH值等于2的醋酸溶液中存在电离平衡,平衡状态下氢离子浓度c(H+)=0.01mol/L,n(H+)=0.01mol,但溶液中醋酸的物质的量大于0.01mol;0.65g锌粒物质的量=![]() =0.01mol,锌和酸反应Zn+2H+=Zn2++H2↑,盐酸酸溶液中氢离子不足,锌剩余0.005mol,醋酸溶液中存在电离平衡,平衡状态下的氢离子不足,但随着反应进行,醋酸又电离出氢离子进行反应,放出的氢气一定比盐酸多,开始时由于氢离子浓度相同,开始的反应速率相同,反应过程中醋酸溶液中的氢离子浓度始终比盐酸溶液中的氢离子浓度大,所以反应速率快,故B正确;
=0.01mol,锌和酸反应Zn+2H+=Zn2++H2↑,盐酸酸溶液中氢离子不足,锌剩余0.005mol,醋酸溶液中存在电离平衡,平衡状态下的氢离子不足,但随着反应进行,醋酸又电离出氢离子进行反应,放出的氢气一定比盐酸多,开始时由于氢离子浓度相同,开始的反应速率相同,反应过程中醋酸溶液中的氢离子浓度始终比盐酸溶液中的氢离子浓度大,所以反应速率快,故B正确;
C.无论反应怎样,在①、②、③、④、⑤各点的溶液中都含有阴离子包括草酸根离子、草酸氢根离子、还有氢氧根离子,所以阴离子种类相同,故C错误;
D.由图象可知:在相同条件下,温度越低,c(SO42-)c(Sr2+)越大,Ksp(SrSO4)越大,a点在283K的下方,属于不饱和溶液,故D正确;
故选:C。


 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细化工产品,是一元中强酸,具有较强还原性。回答下列问题:
(1)H3PO2及其与足量氢氧化钠反应生成的NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①在H3PO2中,磷元素的化合价为________在酸性环境中,利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为:________(填化学式)。
②NaH2PO2是________(填“正盐”或“酸式盐”),其溶液中离子浓度由大到小的顺序应为________
(2)次磷酸(H3PO2)可以通过电解的方法制备.工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
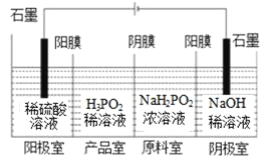
①写出阳极的电极反应式________
②分析产品室可得到H3PO2的原因________(结合一定的文字分析)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示。
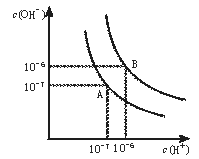
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从___增加到___。
(2)将100℃的pH=8的Ba(OH)2溶液与100℃的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为___。
(3)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)___。
A.9 B.13 C.11~13之间 D.9~11之间
(4)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)___。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH-)减小
(5)室温下,如果将0.1molNH4Cl和0.05molNaOH全部溶于水,形成混合溶液(假设无损失),
①___和____两种粒子的物质的量之和等于0.1mol。
②___和___两种粒子的物质的量之和比OH-多0.05mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,向10L容积不变的密闭容器中加入1.0molNH2COONH4,发生反应NH2COONH4(s)![]() CO2(g)+2NH3(g) ΔH>0。5min达到平衡时,测得容器中NH2COONH4(s)的物质的量为0.2mol。下列说法正确的是
CO2(g)+2NH3(g) ΔH>0。5min达到平衡时,测得容器中NH2COONH4(s)的物质的量为0.2mol。下列说法正确的是
A. 0~5min内,v(CO2)=0.16mol·L-1·min-1
B. 氨气体积分数不变时,该反应一定达到平衡状态
C. 平衡后,缩小容器容积,重新建立平衡时,c(CO2)增大
D. 其他条件不变,若将原容器改为绝热容器,则达到平衡时,NH2COONH4的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答问题:
Ⅰ.常温下,CaS的Ksp=10-8,饱和溶液中存在平衡: CaS(s)![]() Ca2+(aq)+S2-(aq)
Ca2+(aq)+S2-(aq)
(1)①该温度下,将10-4mol/L氯化钙溶液与2×10-4mol/L硫化钠溶液等体积混合,能否产生沉淀?答___;温度升高时,Ksp__(填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c(Ca2+)___,原因是___(用文字和离子方程式说明)。
(2)若向CaS悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式___。
Ⅱ.(已知Ksp[Fe(OH)3]=10-38)若0.01mol/L FeCl3溶液中,如果要生成Fe(OH)3沉淀,应调整溶液pH,使pH___,若要使其沉淀完全,pH应___。(提示:填数据时,要有>,<,=)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
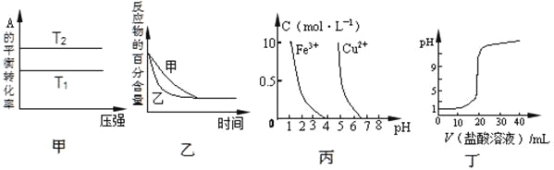
A.由图甲可以判断:若T1>T2,反应A(g)+ B(g)![]() 2C(g)的△H<0
2C(g)的△H<0
B.图乙表示压强对可逆反应2A(g)+2 B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.根据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4
D.图丁表示用0.1mol/L的盐酸滴定20mL 0.1mol/LNaOH溶液,溶液pH随加入盐酸体积的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化汞(HgS)难溶于水,在自然界中呈红褐色,常用于油画颜料,印泥及朱红雕刻漆器等。某温度时,HgS在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
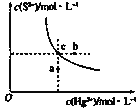
A.向硫化汞的浊液中加入硫化钠溶液,硫化汞的Ksp减小
B.图中a点对应的是饱和溶液
C.向c点的溶液中加入Hg(NO3)2,则c(S2-)减小
D.升高温度可以实现c点到b点的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在密闭容器中发生如下反应:N2O4(g)![]() 2NO2(g) △H>0,反应达到平衡时,下列说法不正确的是 ( )
2NO2(g) △H>0,反应达到平衡时,下列说法不正确的是 ( )
A.若缩小容器的体积,则容器中气体的颜色先变深后又变浅,且比原平衡颜色深
B.若压强不变,向容器中再加入一定量的N2O4,再次达到平衡时各种物质的百分含量不变
C.若体积不变,向容器中再加入一定量的N2O4,平衡向逆反应方向移动,再次平衡时N2O4的体积分数将增大
D.若体积不变,升高温度,再次平衡时体系颜色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol/LCuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,已知:lg2=0.3,Ksp(ZnS)=3×10-25 。下列有关说法正确的是( )

A.a、b、c三点中,水的电离程度最大的为b点
B.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
C.该温度下Ksp(CuS)=4×10-36
D.向100 mL Zn2+、Cu2+浓度均为10-5 mol/L的混合溶液中逐滴加入10-4 mol/L的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com