
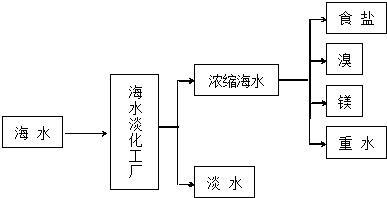
分析 (1)目前淡化海水的方法有多种,常用方法有蒸馏、电渗析以及离子交换法等,以此解答.
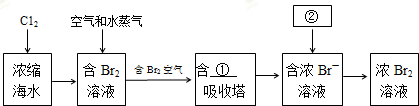
(2)从浓缩海水中提取溴,先进行溴离子的氧化得到溴单质,利用二氧化硫吸收溴单质富集得到溴离子,最后再次用氯气氧化;
(3)MgO的熔点为2852℃、熔点高,电解时耗能高;
(4)食盐水中含有杂质离子Mg2+、Ca2+,一定条件下生成沉淀损害离子交换膜;根据电解食盐水的产物之间能反应;
(5)利用三段分析法,根据平衡时H2与SiHCl3物质的量浓度,求出的起始物质的量,再根据2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH,求出理论上消耗纯NaCl的质量.
解答 解:(1)目前淡化海水的方法有多种,海水淡化工厂通常采用的制备淡水的方法有:蒸馏法、电渗析法;
故答案为:蒸馏法、电渗析法;
(2)从浓缩海水中提取溴,先进行溴离子的氧化得到 溴单质,利用二氧化硫吸收溴单质的富集得到溴离子,最后再次用氯气氧化,吸收塔中发生的化学反应方程式为:SO2+Cl2+2H2O=H2SO4+2HCl;
故答案为:SO2;Cl2;SO2+Cl2+2H2O=H2SO4+2HCl;
(3)MgO的熔点为2852℃、熔点高,电解时耗能高,所以工业上,电解熔融MgCl2冶炼金属镁;
故答案为:MgO熔点很高,熔点高会消耗大量电能;
(4)用试剂处理后的盐水中还含有少量Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜,所以要用阳离子交换塔除去Mg2+、Ca2+;电解食盐水的产物有氯气、氢气和氢氧化钠,氯气与氢氧化钠能反应,氢气与氯气也能反应,所以电解食盐水在离子交换膜电解槽中进行;
故答案为:用试剂处理后的盐水中还含有少量Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜;防止H2与C12混合发生爆炸,同时防止C1-进入阴极室,这样可以获得纯净的NaOH;
(5)反应方程式可知:3SiCl4(g)+2H2(g)+Si(s)?4SiHCl3(g)
起始量(mol) n 0
变化量(mol) 2x x 4x
平衡量(mol) n-2x 4x
则:4x=0.020mol/L×20L=0.4mol,x=0.1mol,
n-2x=0.140mol/L×20L=2.8mol,n=3.0mol,
由2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH,
2mol 1mol
$\frac{2×58.5g}{1mol}$=$\frac{m(NaCl)}{3mol}$;
解得:m(NaCl)=350g=0.35kg,
故答案为:0.35.
点评 本题主要是考查了海水提取镁的过程分析,涉及知识点比较多,要求学生有完整的知识结构和分析问题以及灵活应用基础知识解决实际问题的能力,题目难度中等.注意电化学原理在氯碱工业中的应用,难点是有关根据方程式进行的计算,解得时注意根据方程式找出有关量之间的关系.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 质子数为118,电子数为179,中子数为179 | |
| B. | 原子序数为179,质量数为297 | |
| C. | 与612C的相对原子质量之比为118:6 | |
| D. | 118297X经过一次α衰变得到的116号元素原子可表示116293X |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 编号 性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径/10-10m | 0.77 | 0.99 | 1.86 | 0.75 | 1.17 | 1.02 | 1.43 | 0.71 | 1.52 | 0.89 |
| 最高正化合价 | +4 | +7 | +1 | +5 | +4 | +6 | +3 | +1 | +2 | |
| 最低负化合价 | -4 | -1 | -3 | -4 | -2 | -1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
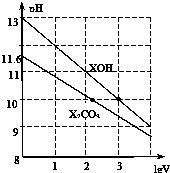 体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是( )
体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是( )| A. | XOH是强碱 | |
| B. | pH=10的两种溶液中的c(X+):XOH大于X2CO3 | |
| C. | 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1×10-10•2 | |
| D. | 当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Fe3+、SO42-、Cl- | B. | CO32-、PO43-、K+、Na+ | ||
| C. | Na+、SO42-、NO3-、Cl- | D. | HCO3-、Na+、HSO3-、K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com