
含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O。
(1)Cu+基态核外电子排布式为__________。
(2)与OH-互为等电子体的一种分子为________(填化学式)。
(3)醛基中碳原子的轨道杂化类型是____________;1 mol乙醛分子中含有的σ键的数目为__________。
(4)含有NaOH的Cu(OH)2悬浊液与乙醛反应的化学方程式为____________________________________________________________。
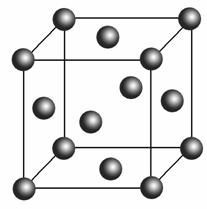
(5)Cu2O在稀硫酸中生成Cu和CuSO4。铜晶胞结构如右图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为________。
解析 (1)Cu的原子序数为29,根据洪特规则特例:能量相同的原子轨道在全充满(如p6和d10)、半充满(如p3和d5)和全空(如p0和d0)状态时,体系的能量较低,原子较稳定,因此Cu原子的基态核外电子排布式为1s22s22p63s23p63d104s1,故Cu+核外基态电子排布式为1s22s22p63s23p63d10。(2)OH-为10电子微粒,电子数相等、原子数相等的微粒之间互为等电子体,故可以是HF。(3)醛基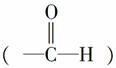 中所有原子在同一平面上,因此中心C原子为sp2杂化;乙醛的结构简式为CH3CHO,CH3CHO中,C—H键是σ键,C===O中,一个键是σ键,另一个键是π键,C—C键是σ健,因此1 mol CH3CHO中有6 mol σ键。(4)CH3CHO被新制Cu(OH)2氧化为CH3COOH,CH3COOH再与NaOH反应生成CH3COONa。(5)根据晶胞可知,铜晶体是面心立方结构,
中所有原子在同一平面上,因此中心C原子为sp2杂化;乙醛的结构简式为CH3CHO,CH3CHO中,C—H键是σ键,C===O中,一个键是σ键,另一个键是π键,C—C键是σ健,因此1 mol CH3CHO中有6 mol σ键。(4)CH3CHO被新制Cu(OH)2氧化为CH3COOH,CH3COOH再与NaOH反应生成CH3COONa。(5)根据晶胞可知,铜晶体是面心立方结构, 顶点离面心的铜原子距离最近,一个晶胞中,一个顶点离它最近的面心铜原子有3个,经过一个顶点的晶胞有8个,共24个面心铜原子,1个面心铜原子由2个晶胞共用,故每个铜原子周围距离最近的铜原子有12个。
顶点离面心的铜原子距离最近,一个晶胞中,一个顶点离它最近的面心铜原子有3个,经过一个顶点的晶胞有8个,共24个面心铜原子,1个面心铜原子由2个晶胞共用,故每个铜原子周围距离最近的铜原子有12个。
答案 (1)[Ar]3d10或1s22s22p63s23p63d10
(2)HF
(3)sp2 6 NA或6×6.02×1023个
(4)2Cu(OH)2+CH3CH O+NaOH
O+NaOH CH3COONa+Cu2O↓+3H2O (5)12
CH3COONa+Cu2O↓+3H2O (5)12


科目:高中化学 来源: 题型:
下列反应中,不属于四种基本反应类型,但属于氧化还原反应的是
A. 2Na + 2H2O ==2NaOH + H2↑ B. CH4 + 2O2==CO2 + 2H2O
C. KClO3==2KCl + 3O2↑ D. CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
已知还原性:HSO >I-,氧化性:IO
>I-,氧化性:IO >I2。
>I2。
(1)在NaIO3溶液中滴加少量NaHSO3溶液,发生下列反应。配平反应方程式,并标出电子转移的方向和数目。
□NaIO3+□NaHSO3―→□I2+□Na2SO4+□H2SO4+□H2O
(2)在NaIO3溶液中滴加过量NaHSO3溶液,反应完全,推测反应后溶液中的还原产物为________________(填化学式)。
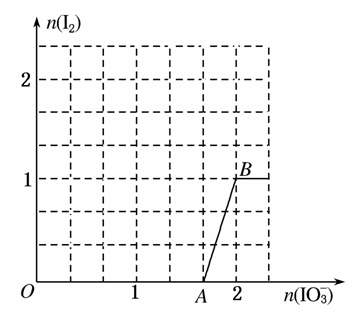
(3)在含5 mol NaHSO3的溶液中逐滴加入NaIO3溶液,加入NaIO3的物质的量和析出I2的物质的量的关系曲线如图所示。写出反应过程中与AB段曲线对应的离子方程式____________;当溶液中I-与I2的物质的量之比为53时,加入的NaIO3为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
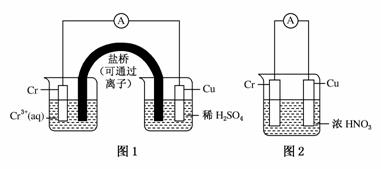
用如图装置进行实验(A为电流计):
观察到现象:
装置图1:Cu电极上产生大量的无色气泡
装置图2:Cu电极上无气泡产生,而Cr电极上产生大量气泡
则下列说法正确的是( )
A.图1是电解池,图2是原电池
B.两个电池中,电子均由Cr电极流向Cu电极
C.图2中Cr电极可能被浓HNO3钝化成惰性电极
D.由实验现象可知金属活动性:Cu>Cr
查看答案和解析>>
科目:高中化学 来源: 题型:
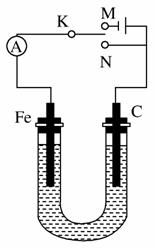
如图所示,用铁棒和石墨棒作电极电解1 L 1 mol/L的食盐水,下列有关说法正确的是( )
A.电键K与N连接,铁棒被保护而免受腐蚀
B.电键K与N连接,正极反应式为4OH--4e-===2H2O+O2↑
C.电键K与M连接,当两极共产生标准状况下气体33.6 L时,理论上生成1 mol NaOH
D.电键K与M连接,将石墨棒换成铜棒,就可实现在铁棒上镀铜
查看答案和解析>>
科目:高中化学 来源: 题型:
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如图所示。
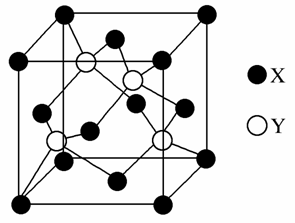
①在1个晶胞中,X离子的数目为________。
②该化合物的化学式为________。
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是________。
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是______________________________________________________________。
(4)Y与Z可形成YZ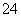 。
。
①YZ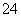 的空间构型为________(用文字描述)。
的空间构型为________(用文字描述)。
②写出一种与YZ 互为等电子体的分子的化学式:________。
互为等电子体的分子的化学式:________。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1 mol该配合物中含有σ键的数目为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氯化亚铜(CuCl)是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:
[已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7]

(金属离子含量与混合液pH、CuCl产率与混合液pH的关系图)
请回答下列问题:
(1)酸浸时发生反应的离子方程式是______________________;析出CuCl晶体时的最佳pH在____左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为________________________________________________________________________。
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70 ℃干燥2小时、冷却,密封包装。70 ℃真空干燥、密封包装的目的是_____________________________________________________________。
(4)产品滤出时所得滤液的主要成分是________________,若想从滤液中获取FeSO4·7H2O晶体,我们还需要知道的是_____________________。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式________________________________________________。为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
A.乙醇和乙酸都是常用调味品的主要成分
B.乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高
C.乙醇和乙酸都能发生氧化反应
D.乙醇与乙酸反应生成乙酸乙酯,说明乙醇具有碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验中,所采取的分离方法与对应原理都正确的是( )
| 选项 | 目的 | 分离方法 | 原理 |
| A | 分离溶于水的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
| D | 除去丁醇中的乙醚 | 蒸馏 | 丁醇与乙醚的沸点相差较大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com