
右图是应用电化学方法检测空气中SO2的原理示意图。下列有关说法不正确的是

A.该装置工作时能将化学能转变为电能,并有H2SO4生成
B.电极b表面O2发生还原反应,电极附近溶液的pH升高
C.气体样品应从电极a区域通入,样品中的SO2在电极a表面得到电子
D.电极a表面的电极反应式为: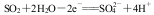
科目:高中化学 来源:2016-2017学年河北省高二上调研三化学卷(解析版) 题型:选择题
在25 ℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是( )
A.c(Na+)=c(CH3COO-)+c(CH3COOH)
B.c(H+)=c(CH3COO-)+c(OH-)
C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2017届北京市高三12月月考化学试卷(解析版) 题型:选择题
下列应用不涉及氧化还原反应的是( )
A.Na2O2用作呼吸面具的供氧剂 B.工业上电解熔融状态的Al2O3制备Al
C.工业上利用合成氨实现人工固氮 D.实验室用NH4Cl和Ca(OH)2制备NH3
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三12月月考化学试卷(解析版) 题型:简答题
锶(Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与 Ca 和Ba同属于同族。
(1)Sr 的原子序数是 ,碱性:Sr(OH)2 Ba(OH)2(填“>”或“<”);锶的化学性质与钙和钡类似,用原子结构的观点解释其原因是 。
(2)碳酸锶是最重要的锶化合物。用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
I.将天青石矿粉和Na2CO3溶液充分混合,过滤;
II.将滤渣溶于盐酸,过滤;
III.向Ⅱ所得滤液中加入浓硫酸,过滤;
IV.向Ⅲ所得滤液中先加入次氯酸,充分反应后再用氨水调pH约为7,过滤;
V.向Ⅳ所得滤液中加入稍过量NH4HCO3,充分反应后,过滤,将沉淀洗净,烘干,得到SrCO3。
已知:i.相同温度时的Ksp :BaSO4<SrCO3<SrSO4<CaSO4
ii.生成氢氧化物沉淀的pH
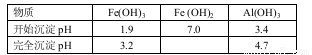
已知氢氧化亚铁的溶度积为1×10—15则Fe2+完全沉淀的pH值为 (完全沉淀时Fe2+的浓度小于1×10—5)
①I中,反应的化学方程式是 。
②II中,能与盐酸反应溶解的物质有 。
③加入次氯酸的有关离子方程式为 ;IV加入氨水的目的是 。
④下列关于该工艺流程的说法正确的是 。
a.该工艺产生的废液含较多的Na+ 、Cl- 、SO42-
b.V中反应时,升高温度一定可以提高SrCO3的生成速率
c.V中反应时,加入NaOH溶液一定可以提高NH4HCO3的利用率
查看答案和解析>>
科目:高中化学 来源:2017届山东省德州市高三12月月考化学试卷(解析版) 题型:填空题
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为______________________。利用反应6NO2+8NH3  7N2+12 H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是__________L。
7N2+12 H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是__________L。
2)已知:2SO2(g)+O2(g)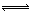 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)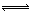 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)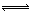 SO3(g)+NO(g)的ΔH=_________kJ·mol、1。
SO3(g)+NO(g)的ΔH=_________kJ·mol、1。
一定条件下,将NO2与SO2以体积比1︰2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1︰6,则平衡常数K=__________________。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)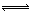 CH3OH(g)。
CH3OH(g)。
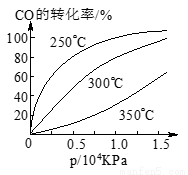
CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH___________0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是________________________。
查看答案和解析>>
科目:高中化学 来源:2017届山东省德州市高三12月月考化学试卷(解析版) 题型:选择题
根据下图所示情 况,判断下列说法中正确的是( )
况,判断下列说法中正确的是( )
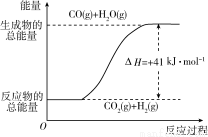
A.其热化学方程式为:CO(g)+H2O(g)===CO2(g)+ H2(g) ΔH=+41 k
H2(g) ΔH=+41 k J·mol-1
J·mol-1
B.该反应为吸热反应
C.该反应为放热反应
D.当H2O为液态时,其反应热值小于41 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上学期阶段考二化学试卷(解析版) 题型:简答题
按要求写出化学方程式:
(1)苯酚与过量的浓溴水反应
(2)制备聚丙烯
(3)实验室制备乙烯
(4)制备TNT
(5)2—丙醇催化氧化
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省慈溪市高二上学期期中化学试卷(解析版) 题型:填空题
按下图所示装置进行实验,并回答下列问题:
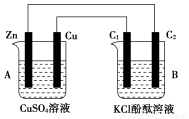
(1)判断装置的名称:A池为________,B池为________。
(2)锌极为________极,电极反应式为________;铜极为________极,电极反应式为________;石墨棒C1为________极,电极反应式为________;石墨棒C2附近发生的实验现象为________。
(3)当C2极析出224 mL气体(标准状况下)时,锌的质量变化为:________,CuSO4溶液的质量变化为:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com