
 ��Ҫ���������С�⣮
��Ҫ���������С�⣮| V |
| Vm |
| m |
| n |
| 1000�Ѧ� |
| M |
| 0.224L |
| 22.4L/mol |
| 0.64g |
| 0.01mol |
| 1000�Ѧ� |
| M |
| 1000��1.19��36.5% |
| 36.5 |
| 200mL��1mol/L |
| 11.9mol/L |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ѧƽ�ⳣ������λ |
| B��ƽ�ⳣ��Խ����ת����Խ�� |
| C������һ����ѧ�������̶��ķ�Ӧ��ƽ�ⳣ���Ĵ�Сֻ���¶��й� |
| D����ƽ�ⳣ������ʽ�У���Ӧ���Ũ��Ϊ��ʼŨ�ȣ��������Ũ��Ϊƽ��Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
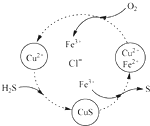 ������и�С��ļ���
������и�С��ļ����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��1L��Һ�к���K+��Ŀ��0.1NA |
| B��1L��Һ�к���K+��SO42-����Ϊ0.1NA |
| C��1 L��Һ��K+��Ũ����0.05 mol?L-1 |
| D��2 L��Һ�к���SO42-��Ũ����0.1mol?L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��2Na2O2+2CO2�T2Na2CO3+O2�� |
| B��2Na2O2+2SO3�T2Na2SO4+O2�� |
| C��Na2O2+H2SO4�TNa2SO4+H2O2 |
| D��3Na2O2+Cr2O3�T2Na2CrO4+Na2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���Ȼ�ͭ��Һ�����۷�Ӧ��CuCl2+Fe�TFe2++Cu+2Cl- |
| B��ϡH2SO4�����۷�Ӧ��2Fe+6H+�T2Fe3++3H2�� |
| C������������Һ��ϡH2SO4��Ӧ��Ba2++SO42-�TBaSO4�� |
| D��������������Һ�����Ȼ������壺H++OH-�TH2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������������ ������ |
| B����Һ ���� |
| C������� ������ |
| D������� ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����⾫��ͭʱ��ͬһʱ���������ܽ�ͭ����������������ͭ��������� |
| B���ϳɰ����������н�NH3Һ�����룬�ɼӿ�����Ӧ���ʣ����N2��H2��ת���� |
| C�����ڡ�H��0����S��0�ķ�Ӧ���������Է����У���Ӧ����Ҳ�ܿ� |
| D��S��g��+O2��g��=SO2��g����H1��S��s��+O2��g��=SO2��g����H2�����H1����H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com