
【题目】下列离子方程式书写正确的是( )
A.用Cu片作阳极电解饱和食盐水:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.用两个铜片作电极电解AgNO3溶液:Cu+2Ag+![]() 2Ag+Cu2+
2Ag+Cu2+
C.用石墨作电极电解FeCl3溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.用石墨作电极电解CuBr2溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
科目:高中化学 来源: 题型:
【题目】I.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表,回答下列问题:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表,回答下列问题:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=___。
(2)该反应为___反应(选填吸热、放热)。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为___K。
II.将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
(1)用C表示10s内反应的平均反应速率为___。
(2)反应前A的物质的量浓度是___。
(3)10s末,生成物D的浓度为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.因为反应物浓度越大,反应速率越快,所以常温下,相同的铝片中分别加入足量的浓硝酸、稀硝酸中,浓硝酸中铝片先溶解完
B.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
C.N2(g)+3H2(g)![]() 2NH3(g)ΔH<0,其他条件不变时升高温度,反应速率v(H2)和H2的转化率均增大
2NH3(g)ΔH<0,其他条件不变时升高温度,反应速率v(H2)和H2的转化率均增大
D.对于反应2H2O2===2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O:
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是_______________。
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子
(ClO2-)。2001年我国卫生部规定,饮用水中ClO2-的含量应不超过0.2mg·L-1。
饮用水中ClO2、ClO2-的含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如图所示。

当pH≤2.0时,ClO2-也能被I-还原成Cl-。
反应生成的I2用标准Na2S2O3溶液滴定: Na2S2O3+I2=Na2S4O6+2NaI
①请写出pH≤2.0时,ClO2-与I-反应的离子方程式______________________。
②请完成相应的实验步骤:
步骤1:准确量取VmL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4:加入少量淀粉溶液,用cmol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5:______________________。
步骤6:再用cmol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
③根据上述分析数据,测得该饮用水样中ClO2-浓度为_____________mol·L-1用含字母的代数式表示)
④若饮用水中ClO2-的含量超标,可向其中加入适量的Fe2+将ClO2-还原成Cl-,该反应的氧化产物是___________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为__________,该元素的符号是__________;
 (2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为____________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________;
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图能量关系示意图,下列说法正确的是
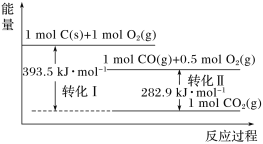
A. 1 mol C(s)与1 mol O2(g)的能量之和为393.5 kJ
B. 反应2CO(g)+O2(g)= 2CO2(g)中,生成物的总能量大于反应物的总能量
C. 由C(s)→CO(g)的热化学方程式为:2C(s)+O2(g)= 2CO(g) ΔH=-221.2 kJ·mol-1
D. 热值指一定条件下单位质量的物质完全燃烧所放出热量,则CO热值ΔH=-10.1 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略。)
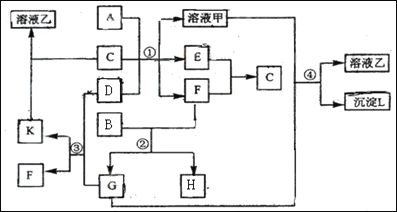
(1)A、B、C、D代表的物质分别为_______、________、_______、_______(填化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是_______;
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是_______、________(填化学式);
(4)反应③产物中K的化学式为______________________________;
(5)反应④的离子方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼![]() 是重要的化工原料,广泛地应用于医药、农药、染料等。其在工业上常利用尿素氧化法制备,反应原理为
是重要的化工原料,广泛地应用于医药、农药、染料等。其在工业上常利用尿素氧化法制备,反应原理为![]() 。某同学在实验室模仿工业制备方法制备
。某同学在实验室模仿工业制备方法制备![]() 。回答下列问题:
。回答下列问题:
(1)![]() 溶液的制备,装置如图所示。
溶液的制备,装置如图所示。
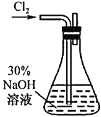
①实验室利用二氧化锰和浓盐酸制备氯气的离子方程式为_________________。
②实验需要用到![]() 的NaOH溶液,配制该溶液所需玻璃仪器除量筒外还有_____。
的NaOH溶液,配制该溶液所需玻璃仪器除量筒外还有_____。
③锥形瓶中发生反应的化学方程式为___________________________。
④因后续实验需要,需利用中和滴定原理测定反应后锥形瓶中混合溶液中NaOH的浓度。利用所提供试剂,设计实验方案:____________________________所提供的试剂有:![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 的盐酸、酚酞试液。
的盐酸、酚酞试液。
(2)水合肼的制备,装置如图所示。
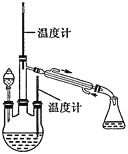
实验步骤:控制反应温度![]() 加热装置已省略
加热装置已省略![]() ,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应后,持续加热蒸馏三颈烧瓶内的溶液,收集
,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应后,持续加热蒸馏三颈烧瓶内的溶液,收集![]() 馏分于锥形瓶中。已知
馏分于锥形瓶中。已知![]() 。分液漏斗中的溶液是_________
。分液漏斗中的溶液是_________![]() 填“
填“![]() 溶液”或“NaOH和NaClO混合溶液”
溶液”或“NaOH和NaClO混合溶液”![]() ,选择的理由是___________。
,选择的理由是___________。
(3)馏分中水合肼含量的测定。
称取馏分![]() ,加入适量的
,加入适量的![]() 固体
固体![]() 滴定过程中,控制溶液的pH保持在
滴定过程中,控制溶液的pH保持在![]() 左右
左右![]() ,加水配成
,加水配成![]() 溶液,移出
溶液,移出![]() ,用
,用![]() 的
的![]() 溶液滴定。实验测得消耗
溶液滴定。实验测得消耗![]() 溶液的平均值为
溶液的平均值为![]() ,馏分中水合肼
,馏分中水合肼![]() 的质量分数为_____。
的质量分数为_____。![]() 已知:
已知:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com