
| A. | CH3COOH和CH3COOCH3 | B. | CH3CH2OH 和CH3OCH3 | ||
| C. | CH3OCHO和HCOOCH3 | D. | 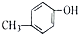 和 和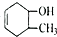 |
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:选择题
| A. | CaCO3(CaO) | B. | Na2O2(Na2O) | C. | Na2CO3(NaHCO3) | D. | MgO[Mg(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 分子式 | 同分异构体数目 |
| A | C4H8O2 | 1 |
| B | C6H12O2 | 2 |
| C | C8H16O2 | 3 |
| D | C10H20O2 | 4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| W | X | ||
| Y | Z |
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小顺序:r(Z)>r(W)>r(Y) | |
| B. | Y的简单气态氢化物的热稳定性比W的强 | |
| C. | Z和Y形成的原子个数比为1:1和2:1的化合物中化学键类型相同 | |
| D. | X的最高价氧化物对应水化物的酸性比W的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
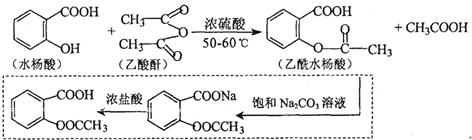
 .
. .
.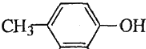 也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件:
也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 共价键 | H-H | N≡N | H-N |
| 键能(kJ•mol-1) | 436 | 945 | 391 |
| 装置 | 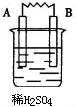 | 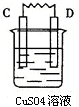 | 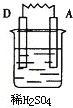 | 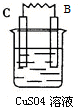 |
| 现象 | 金属A不断溶解 | C的质量增加 | A上有气体产生 | 金属B不断溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com