
分析 在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中,Mn元素的化合价降低,Cl元素的化合价升高,根据化合价的变化判断转移的电子数,反应中16molHCl参加反应,其中10mol被氧化,另外6mol作为酸与金属离子结合,以此来解答.
解答 解:(1)反应中2molKMnO4得到10mol电子,HCl失去10mol电子,则单线桥法标出电子转移的方向和数目为: ,故答案为:
,故答案为: ;
;
(2)在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O的反应中,Mn元素化合价降低,所以KMnO4 是氧化剂,
HCl中Cl元素化合价升高,反应物HCl是还原剂,具有还原性,Cl元素被氧化,对应产物Cl2是氧化产物,反应中16molHCl参加反应,其中10mol被氧化,另外6mol作为酸与金属离子结合,则被氧化与未被氧化的HCl的质量之比比为5:3;
若有7.3g HCl被氧化,2HCl~Cl2,则生成Cl2为7.1g,转移电子数目为:0.2NA或1.204×1023;故答案为:KMnO4; Cl2;7.1g;0.2NA或1.204×1023.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应概念的判断的考查,注意从化合价角度分析,难度不大.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:解答题
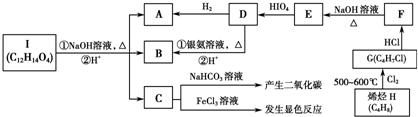
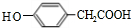 ,E
,E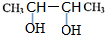 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-+H2O═CO32-+H3O+ | B. | NaCl(S)═Na+(aq)+Cl-(aq) | ||
| C. | S2-+H2O?H2S+2OH- | D. | SiO32-+H2O?H2SiO3+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
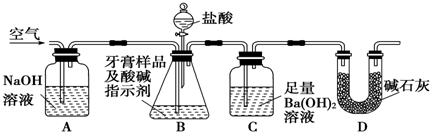
| 实验步骤 | 预期现象与结论 |
| 取适量牙膏样品于试管中,加入足量的NaOH溶液,过滤, 向滤液中滴加盐酸. | 滤液中先出现白色沉淀, 随后沉淀溶解,说明该牙膏摩擦剂中含氢氧化铝. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固体NaCl不导电,所以NaCl是非电解质 | |
| B. | 蔗糖、酒精在水溶液和熔融状态时均不导电,所以它们是非电解质 | |
| C. | 铜、石墨均导电,所以它们是电解质 | |
| D. | CO2的水溶液能导电,所以CO2是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
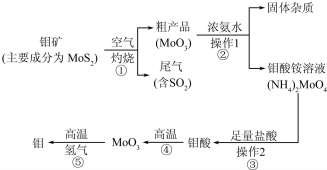
| 化学式 | 电离常数 |
| H2SO3 | K1=1.3×10-2,K2=6.2×10-8 |
| H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
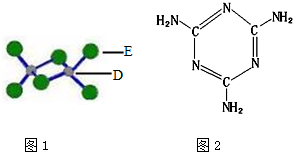 A、B、C、D、E为原子序数依次增大的短周期元素,B、C相邻且同周期,C原子中含有8种运动状态不同的电子.A、C能形成两种化合物甲和乙,原子个数比分别为2:1和1:1,甲为常见的溶剂.D是地壳中含量最多的金属元素.E元素为同周期电负性最大的元素.E和D可形成化合物丙.F为第四周期未成对电子数最多的元素
A、B、C、D、E为原子序数依次增大的短周期元素,B、C相邻且同周期,C原子中含有8种运动状态不同的电子.A、C能形成两种化合物甲和乙,原子个数比分别为2:1和1:1,甲为常见的溶剂.D是地壳中含量最多的金属元素.E元素为同周期电负性最大的元素.E和D可形成化合物丙.F为第四周期未成对电子数最多的元素查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com