
【题目】为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。回答下列问题:
(1)Ag与Cu在同一族,则Ag在周期表中___(填“s”、“p”、“d”或“ds”)区。[Ag2(NH3)2]+中Ag+空的5s轨道和5p轨道以sp杂化成键,则该配离子的空间构型是___。
(2)下表是Fe和Cu的部分电离能数据:请解释I2(Cu)大于I2(Fe)的主要原因:______。
元素 | Fe | Cu |
第一电离能I1/kJ·mol-1 | 759 | 746 |
第二电离能I2/kJ·mol-1 | 1561 | 1958 |
(3)亚铁氰化钾是食盐中常用的抗结剂,其化学式为K4[Fe(CN)6]。
①CN-的电子式是______;1 mol该配离子中含σ键数目为____。
②该配合物中存在的作用力类型有_____(填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(4)MnO2的熔点(1660℃C)比MnS的熔点(1610℃)高,其主要原因是_________。
(5)第三代太阳能电池利用有机金属卤化物碘化铅甲胺(CH3NH3PbI3)半导体作为吸光材料,CH3NH3PbI3具有钙钛矿(AMX3)的立方结构,其晶胞如图所示。

①AMX3晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则M处于____位置,X处于____位置。
③CH3NH3PbI3晶体的晶胞参数为anm,其晶体密度为dg·cm-3,则阿伏加德罗常数的值NA的计算表达式为______。
【答案】ds 直线形 失去第二个电子时,Cu 失去的是全充满 3d10 电子,Fe 失去的是 4s1 电子 ![]() 12 NA BCD 二者均为离子晶体,O2-半径小于 S2-半径,MnO 的晶格能大于 MnS 体心 面心 620/(a×10-7)3d
12 NA BCD 二者均为离子晶体,O2-半径小于 S2-半径,MnO 的晶格能大于 MnS 体心 面心 620/(a×10-7)3d
【解析】
(1)Ag位于第五周期第ⅠB族,外围电子排布为4d55s1,属于ds区;
[Ag2(NH3)2]+中Ag+空的5s轨道和5p轨道以sp杂化成键,所以其空间构型为直线型结构;
(2)根据表中数据可知,I2(Cu)大于I2( Fe),主要原因为:失去第二个电子时,Cu 失去的是全充满 3d10 电子,Fe 失去的是 4s1 电子;
(3)①CN-中碳与氮之间形成三对共用电子对,电子式是![]() ;1 mol该配离子[Fe(CN)6]4-中,CN-与铁离子之间有6个配位键,在每个CN-内部有一个共价键,所以1mol该配合物中含有σ键的数目为12NA;
;1 mol该配离子[Fe(CN)6]4-中,CN-与铁离子之间有6个配位键,在每个CN-内部有一个共价键,所以1mol该配合物中含有σ键的数目为12NA;
②K4[Fe(CN)6]中钾离子与[Fe(CN)6]4-之间形成离子键、[Fe(CN)6]4-中CN-与铁离子之间形成配位键、CN-中碳原子与氮原子之间形成共价键,故存在的作用力类型有离子键、共价键、配位键。答案选BCD;
(4)MnO2的熔点(1660℃)比MnS的熔点(1610℃)高,其主要原因是二者均为离子晶体,O2-半径小于 S2-半径,MnO 的晶格能大于 MnS;
(5)①AMX3晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,根据图中离子的位置关系可知,M处于体心位置,X处于面心位置;
③CH3NH3PbI3晶体的晶胞参数为anm,其晶体密度为dg·cm-3,根据![]() 可知 dg·cm-3=
可知 dg·cm-3= ,则阿伏加德罗常数的值NA的计算表达式为
,则阿伏加德罗常数的值NA的计算表达式为 。
。


科目:高中化学 来源: 题型:
【题目】研究生铁的锈蚀,下列分析不正确的是
序号 | ① | ② | ③ |
实验 |
|
|
|
现象 | 8小时未观察 到明显锈蚀 | 8小时未观察 到明显锈蚀 | 1小时观察 到明显锈蚀 |
A. ①中,NaCl溶液中溶解的O2不足以使生铁片明显锈蚀
B. ②中,生铁片未明显锈蚀的原因之一是缺少H2O
C. ③中正极反应:O2+4e+ 2H2O ==4OH
D. 对比①②③,说明苯能隔绝O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 向澄清石灰水中通入足量二氧化碳:2OH+CO2===![]() +H2O
+H2O
B. 氧化钠投入水中发生反应:![]() +H2O===2OH
+H2O===2OH
C. 醋酸溶液滴入到NaOH溶液中:CH3COOH+OH===CH3COO+H2O
D. 铁和稀盐酸反应制氢气:2Fe+6H+===2Fe3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,地球上的碳循环,光合作用是必不可少的(如下图所示)。下列叙述正确的是
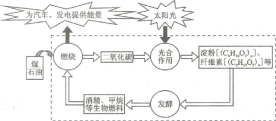
A. 石油与煤是可再生能源
B. CO2是煤、石油形成淀粉、纤维素等的催化剂
C. 光合作用将太阳能转化为化学能
D. 图中所出现的物质中淀粉与纤维素为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O,相对分子质量为180)呈淡黄色,可用作照相显影剂。某实验小组对其进行了一系列探究。
I.纯净草酸亚铁晶体热分解产物的探究。
(1)气体产物成分的探究。小组成员采用如下装置(可重复选用)进行实验:
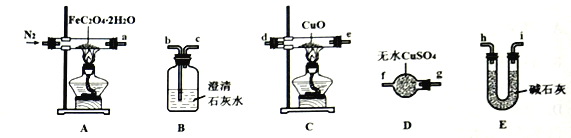
①装置D的名称为___________。
②按照气流从左到右的方向,上述装置的连接顺序为___________→尾气处理装置(填仪器接口的字母编号)。
③实验前先通入一段时间N2,其目的为______________________。
④实验证明了气体产物中含有CO,依据的实验现象为______________________。
(2)固体产物成分的探究。充分反应后,A处反应管中残留黑色固体。查阅资料可知,黑色固体可能为Fe或FeO。小组成员设计实验证明了其成分只有FeO,其操作及现象为___________。
(3)依据(1)和(2)结论,可知A处反应管中发生反应的化学方程式为___________。
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取m g草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液。
步骤2:取上述溶液25.00mL,用c mol· L -1KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol·L-1KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤3中加入锌粉的目的为____________________________________________。
(5)草酸亚铁晶体样品的纯度为____________________________________________;若步骤1配制溶液时部分Fe2+被氧化,则测定结果将___________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种短周期元素的位置如图所示(其中乙、丙、丁的位置未标出)。
![]()
已知四种元素的原子序数之和为36,乙的原子序数与甲、丁原子序数之和相等。
(1)甲元素在周期表中的位置为______________。
(2)丙、丁可形成AB2型化合物,其化学式为________。
(3)丙是自然界中形成化合物种类最多的元素,则丙是________(填名称),其单质与甲元素的最高价氧化物对应水化物的浓溶液共热时反应的化学方程式是______________________。
(4)若甲、乙、丙、丁四种元素两两化合时,丁与其他三种元素得到的化合物种类最多,则丁是________(填元素符号),写出这些化合物中任意两种符合以下条件的化学式______________________
(①原子个数比为1∶2;②分子中价电子总数为偶数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。

请填写下列空白:
(1)写出化学式:A____,B____,C_____,D____,E____。
(2)以上反应中,属于氧化还原反应的有____________(填写编号)。
(3)A→C反应的离子方程式是________。
(4) B→C反应的化学方程式是____________。
(5)E→D反应的化学方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. CaCO3+2HCl=CaCl2+CO2↑+ H2O
B. CaO+H2O=Ca(OH)2
C. 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
D. CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
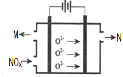
【题目】研究氮氧化物反应机理,对于控制汽车尾气、保护环境有重要意义。
(1)NO在空气中存在如下反应:2NO(g) + O2(g) ![]() 2NO2(g) ΔH,上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变ΔH2用含ΔH、ΔH1的式子来表示): ① 2NO(g)
2NO2(g) ΔH,上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变ΔH2用含ΔH、ΔH1的式子来表示): ① 2NO(g) ![]() N2O2(g)ΔH1<0,② ___________;
N2O2(g)ΔH1<0,② ___________;
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应的热化学方程式为: 4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g)△H=-1811.63KJ/mol;反应在恒容密闭容器中进行,在其它相条件同时,选用不同的催化剂,反应产生N2的物质的量随时间变化如图所示。
5N2(g)+6H2O(g)△H=-1811.63KJ/mol;反应在恒容密闭容器中进行,在其它相条件同时,选用不同的催化剂,反应产生N2的物质的量随时间变化如图所示。
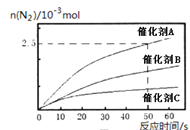
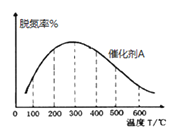
①在催化剂A的作用下,经过相同时间,测得脱氮率随反应温度的变化情况如图2所示,据图可知,在相同的时间内,300℃之前,温度升高脱氮率逐渐增大,300℃之后温度升高脱氮率逐渐减小(催化剂均末失效),写出300℃之后脱氮率减小的原因是_________。
②其他条件相同时,请在图中补充在催化剂B作用下脱氮率随温度变化的曲线________。
(3)工业制HNO3的尾气中含有的NO2和NO常用NaOH溶液吸收,反应的化学方程式为:NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O,现有平均组成为NOx的NO、NO2混合气体,通入足量的NaOH溶液中,充分反应后没有气体剩余,则:
①x的取值范围为_________________。
②反应后溶液中n(NO2-)︰n(NO3-)=____________________。(用含x的代数式表示)
(4)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如图示,两电极间是新型固体氧化物陶瓷,在一定条件下可自由传导O2-,电解池阴极反应为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com