
�о����֣�������ʯī������������������������CaF2-CaO������ʣ�������ͼ��ʾװ�û�ý����ƣ����Ը�Ϊ��ԭ����ԭ���������Ʊ������ѡ�����˵���У���ȷ���ǣ� ��
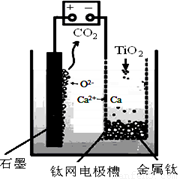
A����TiO2�Ƶ�1mol ����Ti �����������·ת��2 mol����
B�������ĵ缫��ӦʽΪ��C + 2O2- − 4e- == CO2��
C�����Ʊ�������ǰ������װ����CaO����������
D������Ǧ��������װ�õĹ����Դ����+��������Ӧ����Pb�缫����֪Ǧ���طŵ�ʱ���ܷ�ӦΪPb + PbO2 + 2H2SO4 �� 2PbSO4 + 2H2O��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����


| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�콭��ʡ�γ���������ѧ������ѧ��ѧ����п��Ի�ѧ�Ծ����������� ���ͣ���ѡ��
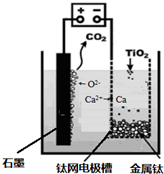
�о����֣�������ʯī������������������������CaF2��CaO������ʣ�������ͼ��ʾװ�û�ý����ƣ����Ը�Ϊ��ԭ������ԭ���������Ʊ������ѡ�����������ȷ����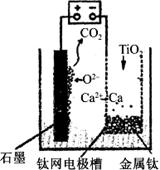
| A���õ�ع���������O2���������ƶ� |
| B�������ĵ缫��ӦʽΪC��2O2����4e��===CO2�� |
| C������Ǧ��������װ�õĹ����Դ��������������Ӧ����PbO2�缫 |
| D�����Ʊ�������ǰ������װ����CaO���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ������人�������������ѧ����ĩ�������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�о����֣�������ʯī������������������������CaF2��CaO������ʣ�����ͼʾװ�û�ý����ƣ����Ը�Ϊ��ԭ����ԭ���������Ʊ������ѡ�����˵������ȷ����
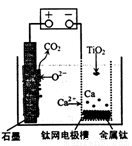
A��������CaF2-CaO����Ca(NO3)2��ҺҲ���Դﵽ��ͬĿ��
B�������ĵ缫��ӦʽΪ��C+2O2��-4e�� CO2��
CO2��
C�����Ʊ�������ǰ������װ����CaO����������
D������Ǧ��������װ�õĹ����Դ����+"������Ӧ����Pb�缫
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��ӱ�ʡ�������п������ۻ�ѧ�Ծ��������棩 ���ͣ������
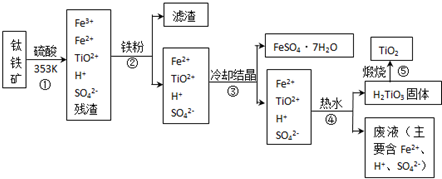
��ҵ�����������ѵķ����ܶࡣ����������Ҫ�ɷ�FeTiO3������������Ϊ��Ҫԭ��ұ�������ѣ������Ĺ�������ͼ���£�������������Ũ���ᷢ����Ӧ�Ļ�ѧ����ʽΪ��
FeTiO3��2H2SO4��TiOSO4��FeSO4��2H2O
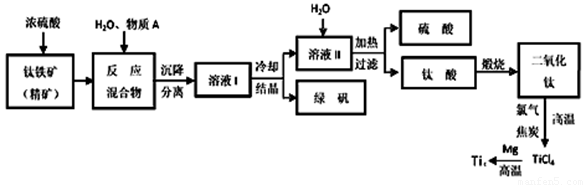
�ش��������⣺
��1���������Ũ���ᷴӦ����______________________ ��ѡ�������ԭ��Ӧ����������ԭ��Ӧ������
��2���������������м�������A��Ŀ���Ƿ�ֹFe2��������������A��________�������Ʊ�TiO2�Ĺ����У����õ��ĸ�����Ϳɻ������õ����ʷֱ���__________��___________��
��3����ӦTiCl4��2Mg��2MgCl2��Ti��Ar�����н��е�������_______________��
��4���ɶ���������ȡ���Ȼ������漰�ķ�Ӧ�У�
TiO2 (s)+ 2Cl2 (g) +2C(s) ��TiCl4(g) + 2CO(g) ��H1 = ��72 kJ•mol-1
TiO2(s) + 2Cl2 (g) ��TiCl4(g) + O2 (g) ��H2 =+38.8kJ•mol��1
C(s)��CO2(g)��2CO(g) ��H3 =+282.8kJ•mol��1
�ٷ�ӦC(s)��CO2(g)��2CO(g)�ڸ������ܹ��Է����е�ԭ����______________________��
�ڷ�ӦC(s)��O2(g)��CO2 (g)�Ħ�H��_______________��
��5���о����֣�������ʯī������������������������CaF2-CaO������ʣ�������ͼ��ʾװ�û�ý����ƣ����Ը�Ϊ��ԭ������ԭ���������Ʊ������ѡ���д��������������Ӧ�ĵ缫��Ӧʽ��________________________________��

�����Ʊ�������ǰ��CaO���������䣬��ԭ���ǣ����ϻ�ѧ������ͣ� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com