
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,金属原子之间存在金属键,据此分析.
解答 解:①CaBr2中只存在离子键,属于离子化合物;
②H2O只含有共价键,属于共价化合物;
③H2O2 只含有共价键,属于共价化合物;
④Na2O2中存在离子键和共价键,属于离子化合物;
⑤Al属于金属单质,只存在金属键;
⑥Ca(OH)2中存在离子键和共价键,属于离子化合物;
⑦HClO只含有共价键,属于共价化合物;
⑧I2只含有共价键,属于单质;
⑨He属于单质,不存在化学键;
(1)只含有离子键的是①;故答案为:①;
(2)含有共价键的离子化合物的是④⑥;故答案为:④⑥;
(3)含有共价键的共价化合物是②③⑦;故答案为:②③⑦;
(4)不存在化学键的是He;故答案为:②③⑦.
点评 本题考查了化学键的判断,难度不大,注意金属元素和非金属元素之间可能存在共价键,明确晶体的构成微粒及微粒之间存在的作用力即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
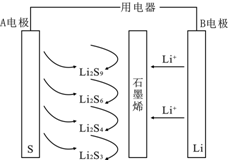 石墨烯锂硫电池放电时的工作原理示意图如图,电池反应为2Li+nS=Li2Sn,有关该电池说法正确的是( )
石墨烯锂硫电池放电时的工作原理示意图如图,电池反应为2Li+nS=Li2Sn,有关该电池说法正确的是( )| A. | 放电时,Li+向负极迁移 | |
| B. | A电极上发生的一个电极反应为:2Li++6S+2e-=Li2S6 | |
| C. | 若对该电池充电,B电极接电源正极 | |
| D. | B电极发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应CaC2(s)+N2(g)=CaCN2(s)+C(s)能自发进行,是因为△H<0 | |
| B. | 若电工操作中将铝线与铜线直接相连,会导致铜线更快被氧化 | |
| C. | 向水中加入NaHCO3或NaHSO4固体后,水的电离程度均增大 | |
| D. | 对于乙酸乙酯的水解反应,加入稀硫酸会使平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||||||||||||
| ⑪ | ⑫ | ||||||||||||||||
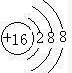 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SO2是形成酸雨的主要气体 | |
| B. | 用碱液吸收燃煤废气可减少环境污染 | |
| C. | 往燃煤中混入生石灰,可减少SO2排放 | |
| D. | 用水溶解、过滤除去煤中的单质硫以减少SO2排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 实验操作 | 现象 | 结论 | |
| A | 在淀粉溶液中加入稀硫酸加热一段时间后冷却至室温,再加入碘水. | 溶液变蓝 | 说明淀粉没有水解 |
| B | 将乙醇与酸性重铬酸钾(K2Cr2O7)溶液混合 | 橙色溶液变为绿色 | 乙醇具有还原性 |
| C | 蔗糖溶液中加入稀硫酸,水解后加入银氨溶液,水浴加热 | 未出现银镜 | 水解的产物中没有葡萄糖 |
| D | 将新制Cu(OH)2与葡萄糖溶液混合加热 | 产生红色沉淀(Cu2O) | 葡萄糖具有氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
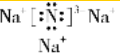 ,该化合物是离子化合物(选填“离子”、“共价”).
,该化合物是离子化合物(选填“离子”、“共价”).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com