

| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案科目:高中化学 来源: 题型:
| A、①④⑤ | B、②③④ |
| C、③④⑤ | D、②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,1mol H2O和1mol H2的体积都约为22.4L |
| B、1molNa2CO3 中Na+ 的物质的量为1mol |
| C、1mol某气体的体积为22.4L |
| D、标准状况下,1g H2和 11.2LO2的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Y的气态简单氢化物的热稳定性比W的强 |
| B、X的最高价氧化物对应水化物的酸性比W的弱 |
| C、Y分别与Z、W形成的化合物均为碱性氧化物 |
| D、原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) |
查看答案和解析>>
科目:高中化学 来源: 题型:
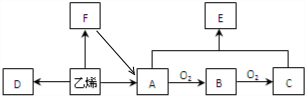
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
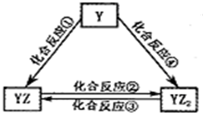 X、Z、Q、R 4种短周期元素的原子序数依次增大,Y是一种短周期主族非金属元素.化合物甲由X、Z、Q 3种元素组成,常温下,0.1mol?L-1甲溶液的pH=13.工业上常用电解QR饱和溶液生产甲.请填写下列空白.
X、Z、Q、R 4种短周期元素的原子序数依次增大,Y是一种短周期主族非金属元素.化合物甲由X、Z、Q 3种元素组成,常温下,0.1mol?L-1甲溶液的pH=13.工业上常用电解QR饱和溶液生产甲.请填写下列空白.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com