
对Na、Mg、Al的有关性质的叙述正确的是 ( )
A.碱性:NaOH<Mg(OH)2<Al(OH)3
B.第一电离能:Na<Mg<Al
C.电负性:Na>Mg>Al
D.还原性: Na>Mg>Al
Na>Mg>Al
科目:高中化学 来源: 题型:
将两金属A、B分别用导线相连接,并同时插入电解质溶液中,发现A极的质量增加,则下列说法正确
的是 ( )
A.金属活动性:A>B
B.A极是正极,电解质溶液可以是盐酸
C.B极是负极
D.要判 断A极与B极是正极还是负极,还需考虑电解质溶液
断A极与B极是正极还是负极,还需考虑电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关用惰性电极电解AgNO3溶液一段时间后的说法正确的是 ( )
A.电解过程中阳极质量不断增加
B.电解过程中溶液的pH不断升高
C.此时向溶液中加入适量的Ag2O固体可使溶液恢复到电解前的状况
D.电解后两极产生的气体体积比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.SiO2制成的纤维,由于导电能力强而被用于制造光缆
B.用一束光线通过氯化钠溶液和蛋白质溶液,能看到相同的现象
C.SO2和Cl2通入品红溶液,品红均褪色,说明两者的漂白原理相同
D.浓硝酸具有强氧化性,能使铝钝化,故常用铝罐车运输冷的浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
溴及其化合物广泛用在有机合成、化学分析等领域。
(1)海水提溴过程中溴元素的变化如下 :
:
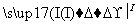
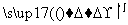
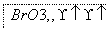
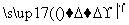
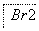
①过程Ⅰ,海水显碱性,调其pH<3.5后,再通入氯气。
ⅰ.通入氯气后,反应的离子方程式是_______________________。
ⅱ.调海水pH可提高Cl2的利用率,用平衡原理解释其原因是______。
②过程Ⅱ,用热空气将溴赶出,再用浓碳酸钠溶液吸收。完成并配平下列方程式。
 Br2+
Br2+ Na2CO3===
Na2CO3=== NaBrO3+
NaBrO3+ CO2+
CO2+ ________
________
③过程Ⅲ,用硫酸酸化可得Br2和Na2SO4的混合溶液。
相同条件下,若用盐酸酸化,则所得溴的质量减少,原因是__________是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入2.6 mol NaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:
| 粒子 | I2 | Br2 | IO |
| 物质的量/mol | 0.5 | 1.3 |
则原溶液中NaI的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E五种短周期元素的原子序数依次增大,上述元素中只有一种金属元素。A、B同周期,
化合物AB2、DB2均是可使澄清石灰水变浑浊的气体。又已知C、E的单质均可溶于NaOH溶液,且C与
NaOH溶液反应可产生气体。
(1)写出C、D、E三种元素的名称:
C.________,D________,E________。
(2)写出AB2使澄清石灰水变浑浊的化学方程式:
________________________________________________________________________。
(3)写出C、E的单质分别与NaOH溶液反应的离子方程式:
______________________________________,_ _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W均为短周期元素,它们在元素
周期表中相对位置如图所示。若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
A.X的最常见气态氢化物的水溶液显酸性
B.最高价氧化物对应水化物的酸性W比Z强
C.Z的单质与氢气反应较W剧烈
D.X的原子半径小于Y
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项叙述中,正确的是 ( )
A.镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态
B.价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素
C.所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同
D.24Cr原子的电子排布式是1s22s22p63s23p63d44s2
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W在周期表中的相对位置如图,W
原子的最外层电子数是其最内层电子数的3倍。下列判断正确的是
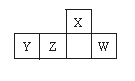 A.原子半径:X>Y>Z>W
A.原子半径:X>Y>Z>W
B.含Y元素的盐溶液有的显酸性,有的显碱性
C.最简单气态氢化物的热稳定性:Z >W
D.X的氢化物能与其最高价氧化物对应的水化物反应生成盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com