
分析 (1)①与④反应生成硫酸铁和水;
(2)上述物质中,既能跟④又能跟⑥反应的物质为Al,Al与NaOH溶液反应生成偏铝酸钠和氢气;
(3)③与⑤在加热条件下反应生成二氧化碳、二氧化硫和水,反应中S元素的化合价降低.
解答 解:(1)①与④反应生成硫酸铁和水,离子反应为Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
(2)上述物质中,既能跟④又能跟⑥反应的物质为②Al,Al与NaOH溶液反应生成偏铝酸钠和氢气,反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:②;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)③与⑤在加热条件下反应生成二氧化碳、二氧化硫和水,反应为C+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,反应中S元素的化合价降低,只体现氧化性,
故答案为:C+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;b.
点评 本题考查较综合,涉及离子反应、化学反应及物质的量的计算,为高频考点,把握发生的反应及物质的量的基本计算公式为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 金不溶于任何溶液 | |
| B. | 铜、锌在空气中均能被氧化成对应的氧化物 | |
| C. | 铜锌合金的熔点低于铜或锌的熔点 | |
| D. | ${\;}_{29}^{63}$Cu的质子数和中子数之差为34 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮气的电子式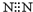 | B. | 乙烯的结构式:C2H4 | ||
| C. | 用电子式表示HCl的形成过程: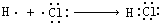 | D. | 乙醇的分子式:C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
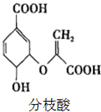
| A. | 分枝酸的分子式为C10H8O6 | |
| B. | 分枝酸能发生取代、加成、氧化反应 | |
| C. | 1mol分枝酸最多可与3molNaOH发生中和反应 | |
| D. | 1mol分枝酸最多可与2molBr2发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将食物储存在冰箱里 | |
| B. | 用块状碳酸钙代替粉末状碳酸钙与稀盐酸反应 | |
| C. | 往H2O2溶液中加入几滴FeCl3溶液 | |
| D. | 用纯锌代替粗锌与1 mol/L H2SO4溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2O的质量为18g/mol | B. | 3.01×1023个SO2分子的质量为32g | ||
| C. | CH4的摩尔质量为16g | D. | 44g CO2含有的O原子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com