
江苏省东海县矿产丰富,除了水晶制品名扬天下外,蛭石、蛇纹石等矿石储量大,品位高,其相关的耐火、保温隔热材料(主要成分为MgO、Al2O3)工业也较发达。某中学化学探究小组通过查阅相关资料,对蛭石的组成进行了实验探究。
Ⅰ.相关资料:①蛭石的成分可看成是由MgO、Fe2O3、Al2O3、SiO2组成;
②氢氧化物开始沉淀及沉淀完全时的pH:
| 氢氧化物 | Fe(OH)3 | Mg(OH)2 | Al(OH)3 |
| 沉淀的pH范围 | 1.5~4.1 | 9.4~12.4 | 3.3~5.2 |

科目:高中化学 来源: 题型:填空题
某研究性学习小组就Na2O2的有关性质探究如下:向滴有酚酞的水中
投入一定量的Na2O2,观察到先有大量气泡产生,溶液变红,过一会儿溶液又变为无色。
对上述实验中溶液变红,过一会儿又退色的原因,甲、乙两同学提出了不同的解释:
甲同学认为是Na2O2与水反应放出氧气,氧气有氧化性,将酚酞氧化而使溶液退色;
乙同学则认为是Na2O2与水反应时产生了H2O2,H2O2的强氧化性使酚酞退色。
(1)乙同学设计了如下实验来证明自己的猜想是正确的:在滴有酚酞的氢氧化钠溶液中滴加3%的H2O2溶液并振荡。
①若乙同学的猜想正确,可观察到的现象是 。
②甲同学针对乙同学的上述验证实验提出还应增做实验才能更直接证明Na2O2与水反应生成了H2O2,甲同学提出要增加的实验是什么?
(2)试设计简单实验证明甲同学的解释是否正确(画出简易装置图,说明简要步骤)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将一块铝硅合金恰好与NaOH溶液完全反应而溶解。
(1)写出合金溶解的离子方程式______________________________________________。
(2)向所得的溶液中加入足量的盐酸,充分反应后,溶液中大量存在的离子为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应TiO2(s)+CCl4(g) TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下: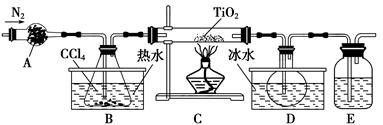
有关物质性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
 H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)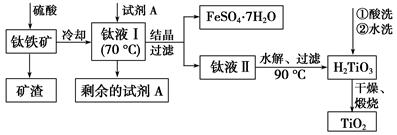
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现代循环经济要求综合考虑环境污染和经济效益。高纯氧化铁可作现代电子工业的材料,
以下是以硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁(软磁αFe2O3)的生产流程示意图: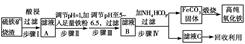
(1)步骤Ⅰ中过滤所得滤渣的主要成分是________。
(2)步骤Ⅱ中加入铁粉的目的是________。
(3)步骤Ⅲ中可选用________调节溶液的pH。
| A.稀硝酸 | B.双氧水 | C.氨水 | D.高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氧化铁在工业上具有广泛的应用。
I.据报道,一定条件下利用FeO2与甲烷反应可制取“纳米级”的金属铁。其反应如下:
Fe2O3(s)+3CH4(g)=2Fe(s)+3CO(g)+6H2(g) △H>0
(1)若反应在2L的密闭容器中进行,5min后达到平衡,测得反应生成Fe的质量为l.12g。则该段时间内CH4的平均反应速率为 ________________。
(2)反应达到平衡后,保持其他条件不变,仅改变某一相关元素,下列说法正确的是___(选填序号)。
a.若加入催化剂,v正增大,平衡向右移动
b.若温度升高,平衡常数K减小
c.若增大Fe2O3的量,平衡向右移动
d.若从反应体系中移走部分CO,可提高CH4的转化率
Ⅱ.工业上利用硫铁矿烧渣(主要成分为Fe2O3、A12O3、SiO2等)为原料提取Fe2O3,工艺
流程如下:试回答下列问题:
(3)步骤i烧渣中A12O3溶解的离子方程式为________________。
(4)步骤i、ⅱ、ⅲ都要进行的操作名称是__________________。
(5)结合下图,判断步骤ⅱ中调节溶液的pH不高于_________________。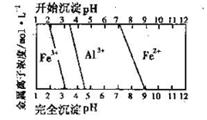
(6)已知
计算反应Fe2+(aq)+2HCO3-(aq) FeCO3(s)+H2CO3(aq)的平衡常数为_______。
FeCO3(s)+H2CO3(aq)的平衡常数为_______。
(7)在空气中煅烧FeCO3生成氧化铁的化学方程式为____________。
(8)结合所学化学知识,请你设计在实验室里从上述的硫铁矿烧渣中提取氧化铁的另一种简单方案。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
合金是建造航空母舰的主体材料。
(1)航母升降机可由铝合金制造。
①铝元素在周期表中的位置为________。工业炼铝的原料由铝土矿提取而得,提取过程中通入的气体为________。
②Al-Mg合金焊接前用NaOH溶液处理Al2O3膜,其化学方程式为____________________________________。
焊接过程中使用的保护气为________(填化学式)。
(2)航母舰体材料为合金钢。
①舰体在海水中发生的电化学腐蚀主要为________。
②航母用钢可由低硅生铁冶炼而成,则在炼铁过程中为降低硅含量需加入的物质为________。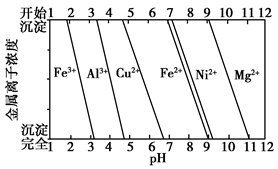
(3)航母螺旋桨主要用铜合金制造。
①80.0 g Cu-Al合金用酸完全溶解后,加入过量氨水,过滤得白色沉淀39.0 g,则合金中Cu的质量分数为________。
②为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调节pH,当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀,结合题图信息推断该合金中除铜外一定含有________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
明矾石经处理后得到明矾[KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示: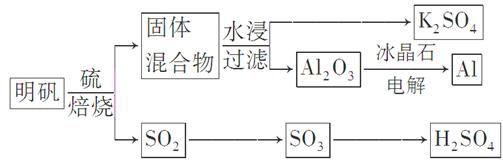 焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是________。
(2)从水浸后的滤液中得到K2SO4晶体的方法是________。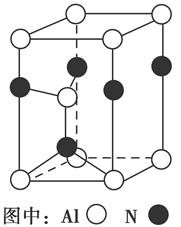
(3)Al2O3在一定条件下可制得AlN,其晶体结构如右图所示,该晶体中Al的配位数是________。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是________。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g)+O2(g) 2SO3(g) ΔH1=-197 kJ/mol;
2SO3(g) ΔH1=-197 kJ/mol;
H2O(g)=H2O(l) ΔH2=-44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) ΔH3=-545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是________。焙烧948 t明矾(M=474 g/mol),若SO2的利用率为96%,可生产质量分数为98%的硫酸________t。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)氧化剂A可选用 (填编号,下同)。
①Cl2 ②H2O2 ③HNO3 ④KMnO4
(2)要得到较纯的产品,试剂B可选用 。
①NaOH ②FeO ③CuO ④Cu2(OH)2CO3
(3)从滤液经过结晶得到氯化铜的方法是 (按实验先后顺序填编号)。
①过滤 ②冷却 ③蒸发浓缩 ④蒸发至干
(4)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x值,某兴趣小组设计了两种实验方案:
方案一:称取m g晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n g。
方案二:称取m g晶体,加入足量10%的氢氧化钠溶液、过滤、洗涤后用小火加热至质量不再减轻为止,冷却、称量所得固体的质量为n g。
①方案一中灼烧CuCl2·xH2O得到无水CuCl2,应在 (填仪器名称)中进行。
方案二中配制一定量10%的氢氧化钠溶液,其操作步骤是计算、称量、 。
②试评价上述两种实验方案,其中可行的方案是 ,另一种方案不可行的理由是 ,若用方案二,计算得x= (用含m、n的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com