
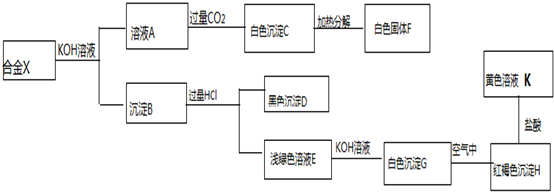
分析 某合金可能由铝、铁、铜、碳等组成,加入KOH,只有Al参加反应,则溶液A为KAlO2,通入过量二氧化碳得到沉淀C为Al(OH)3,加热分解生成F为Al2O3,沉淀B含有铁、铜、碳等,加入过量盐酸,黑色沉淀D含有C,说明不含Cu,浅绿色溶液E含有FeCl2,加入KOH得到白色沉淀G为Fe(OH)2,H为Fe(OH)3,K为FeCl3,以此解答该题.
解答 解:某合金可能由铝、铁、铜、碳等组成,加入KOH,只有Al参加反应,则溶液A为KAlO2,通入过量二氧化碳得到沉淀C为Al(OH)3,加热分解生成F为Al2O3,沉淀B含有铁、铜、碳等,加入过量盐酸,黑色沉淀D含有C,说明不含Cu,浅绿色溶液E含有FeCl2,加入KOH得到白色沉淀G为Fe(OH)2,H为Fe(OH)3,K为FeCl3,
(1)由以上分析可知合金中肯定含有的金属是Al、Fe,故答案为:Al、Fe;
(2)氢氧化亚铁被氧气氧化为氢氧化铁,反应方程式为:4Fe(OH)2+2H2O+O2=4Fe(OH)3,X生成溶液A的化学反应方程式为2Al+2KOH+2H2O=2KAlO2+3H2↑,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3; 2Al+2KOH+2H2O=2KAlO2+3H2↑;
(3)K为FeCl3,可用KSCN检验,离子方程式为Fe3++3SCN-=Fe(SCN)3,氯化铁与铁反应生成氯化亚铁,反应的离子方程式为2Fe3++Fe=3Fe2+,
故答案为:Fe3++3SCN-=Fe(SCN)3; 2Fe3++Fe=3Fe2+.
点评 本题以无机框图题的形式考查Fe、Al等元素单质及其化合物之间的相互转化关系和逻辑推理能力、化学用语的书写能力,为高考常见题型,侧重于学生的分析能力的考查,注意相关基础知识的积累,难度不大.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:填空题
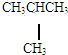
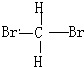 和
和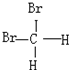 E.葡萄糖和果糖F.(CH3)2CHCH3与C(CH3)4
E.葡萄糖和果糖F.(CH3)2CHCH3与C(CH3)4查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 赤潮、白色污染、绿色食品都与相关物质的颜色有关 | |
| B. | 地震发生后,灾区急需大量消毒剂,其中SO2可用于环境消毒 | |
| C. | 利用太阳能等清洁能源代替化石燃料,有利于节约能源,保护环境 | |
| D. | 电池一定要回收利用,主要是为了避免浪费 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
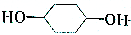 的路线如下图所示.
的路线如下图所示.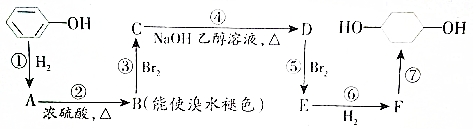
 ,F
,F .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 步骤X中可用MnO2代替双氧水 | |
| B. | 步骤Y中所用的玻璃仪器一定有分液漏斗 | |
| C. | 步骤Y中可用酒精代替CCl4 | |
| D. | 由于碘易升华,步骤Z中不能采取加热蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 贮存液氮的钢瓶防止阳光直射:N2+O2$\frac{\underline{\;阳光\;}}{\;}$2NO | |
| B. | 硝酸铵遇热爆炸:2NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2N2↑+O2↑+4H2O↑ | |
| C. | 干燥的 AlCl3遇水产生气体:AlCl3+3H2O═Al(OH)3+3HCl↑ | |
| D. | 火灾现场存有电石,禁用水灭火:CaC2→Ca(OH)2+C2H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
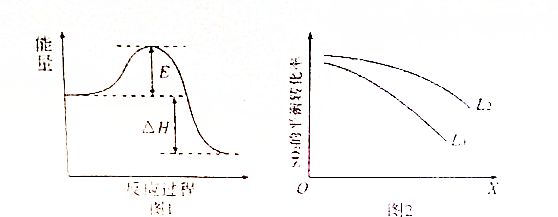
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该固体中一定含有NH4+、CO32-、SO42-、Na+ | |
| B. | 该固体中一定没有Cu2+、Cl-、Na+ | |
| C. | 该固体中只含有NH4+、CO32-、SO42-、Cl- | |
| D. | 根据以上实验,无法确定该固体中有Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com