
分析 (1)将适量的蔗糖放入烧杯中,加几滴水,搅拌均匀,然后加入浓硫酸,生成黑色物质为碳;
(2)脱水过程中反应放热,所生产的碳和浓硫酸反应生成二氧化硫、二氧化碳和水;
(3)反应过程中表现了浓硫酸的脱水性生成碳,还与碳反应生成二氧化硫、二氧化碳和水,表现了强氧化性;
(4)二氧化碳、二氧化硫通入澄清石灰水都能变浑浊,不能用来鉴别;可以利用品红溶液、溴水、酸性高锰酸钾等试剂鉴别两种气体.
解答 解:(1)将适量的蔗糖放入烧杯中,加几滴水,搅拌均匀,然后加入浓硫酸,把蔗糖中的氢元素和氧元素按照2:1脱去,生成黑色物质是C,体现了浓硫酸的脱水性,
故答案为:C;
(2)黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是二氧化硫,反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2H2O+2SO2↑,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2H2O+2SO2↑;
(3)将适量的蔗糖放入烧杯中,加几滴水,搅拌均匀,然后加入浓硫酸,生成黑色物质碳表现了浓硫酸的脱水性,黑色物质继续与浓硫酸作用会产生两种气体,体现了浓硫酸的强氧化性,该过程中没有表现出酸性和吸水性,
故答案为:CD;
(4)根据反应CO2+Ca(OH)2=CaCO3↓+H2O、SO2+Ca(OH)2=CaSO3↓+H2O可知,二氧化硫和二氧化碳通入澄清石灰水都会生成沉淀溶液变浑浊,不能用澄清石灰水鉴别两种气体;可以利用品红试液、溴水或酸性高锰酸钾溶液等鉴别,
故答案为:不能;品红试液、溴水(或酸性高锰酸钾溶液).
点评 本题考查了浓硫酸性质及其应用,题目难度中等,明确发生反应的原理为解答关键,注意熟练掌握浓硫酸的吸水性、脱水性和强氧化性的含义及区别,试题侧重考查学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:解答题
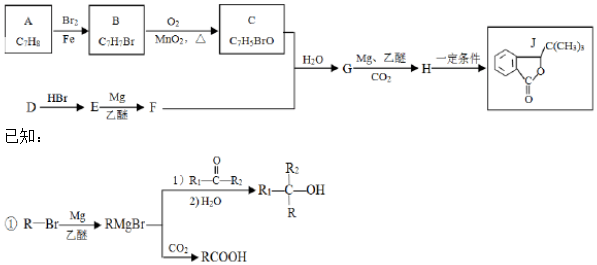
 .
. (写结构简式).
(写结构简式).
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2可用于杀菌、消毒 | B. | HF可用于雕刻玻璃 | ||
| C. | NH3可用于制硝酸 | D. | SiO2可用于制太阳能电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
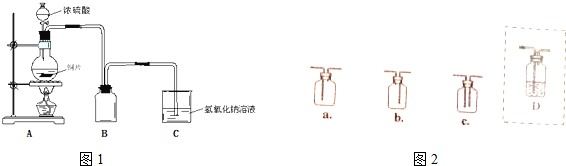
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | N2 | H2 | NH3 |
| 反应前 | 16mol | xmol | 0 |
| 5min | ymol | 28mol | 8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
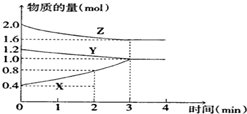 某温度时,在容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
某温度时,在容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 潮湿的氯气通过盛有浓H2SO4的洗气瓶 | |
| B. | 硫化氢通入浓H2SO4中 | |
| C. | 浓H2SO4滴入萤石中,加热 | |
| D. | 加入少量H2SO4使乙酸乙酯水解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com