
【题目】铜的相关化合物在化工、材料等领域有着广泛的应用。回答下列问题:
(1)基态Cu原子中,核外电子占据的最高能层的符号是___________,占据该能层电子的电子_云轮廓图形状为__________;Cu2+价层电子的轨道表达式(电子排布图)为___________。
(2)Cu2O熔点(1235℃)比Cu2S熔点(113℃)高,它们均属于___________晶体,前者熔点较高的原因是_________________________________。
(3)Cu可与N、S,O等元素形成化合物,N、S、O三种元素的第一电离能由大到小的顺序为______________;在Cu的催化作用下,乙醇可被氧化为乙醛,乙醛分子中碳原子的杂化方式是________________。
(4)1mo[Cu(NH3)4]SO4中含有σ键的数目为___________(用NA表示阿伏加德罗常数)。
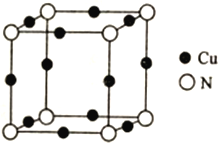
(5)Cu与N所形成的某种晶体的立方晶胞如图所示,其晶胞参数为amm。该晶体的化学式为___________,晶体的密度为___________g·cm-3(列出计算式即可,用NA表示阿伏加德罗常数)。
【答案】N 球形 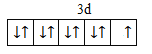 离子 Cu20与Cu2S相比,阳离子相同、阴离子所带的电荷数也相同,但O2-半径比S2-半径小,所以Cu20的晶格能更大,熔点更高 N>O>S sp3 sp2 20NA Cu3N 206×1021/(NA×a3)
离子 Cu20与Cu2S相比,阳离子相同、阴离子所带的电荷数也相同,但O2-半径比S2-半径小,所以Cu20的晶格能更大,熔点更高 N>O>S sp3 sp2 20NA Cu3N 206×1021/(NA×a3)
【解析】
(1) 根据基态Cu原子核外电子排布1s22s22p63s23p63d104s1,判断核外电子占据的最高能层,占据该能层电子的电子云轮廓图形状;画出Cu2+价层电子的轨道表达式;
(2)组成和结构相似的离子晶体,晶格能越大,熔点更高;
(3) 同一主族, 从上到下,第一电离能减小;同周期随原子序数增大,元素第一电离能呈增大趋势,IIA 族、VA族原子第一电离能高于同周期相邻元素;根据价层电子对个数=σ键个数+孤电子对个数,确定甲醛分子中碳原子的杂化方式;
(4)1个NH3中有3个σ键;1个SO42-中含有4个σ键;1个铜原子与4个NH3形成4个配位键;据此进行计算;
(5)利用均摊法计算晶胞中原子个数,从而找出该物质的化学式;先计算1mol晶胞的质量,再根据ρ=m/V求出晶体的密度。
(1) 基态Cu原子核外电子排布: 1s22s22p63s23p63d104s1,核外电子占据的最高能层的符号是N;占据该能层电子的电子云轮廓图形状为球形;Cu2+价层电子的轨道表达式(电子排布图)为,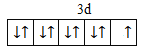 ;综上所述,本题答案是:N;球形;
;综上所述,本题答案是:N;球形; 。
。
(2)Cu20熔点(1235℃)比Cu2S熔点(1130℃)高,其原因是它们都属于离子晶体,但Cu20与Cu2S相比,阳离子相同、阴离子所带的电荷数也相同,但O2-半径比S2-半径小,所以Cu20的晶格能更大,熔点更高;综上所述,本题答案是:离子;Cu20与Cu2S相比,阳离子相同、阴离子所带的电荷数也相同,但O2-半径比S2-半径小,所以Cu20的晶格能更大,熔点更高。
(3) 同一主族, 从上到下,第一电离能减小,同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素原子2p轨道为半满稳定状态,第一电离能高于同周期相邻元素;因此N、S、O三种元素的第一电离能由大到小的顺序为:N>O>S;乙醛中甲基上的C形成4条σ键,无孤电子对,因此采取sp3杂化类型,醛基中的C形成3条σ键和1条π键,无孤电子对,采取sp2杂化类型;
综上所述,本题答案是:N>O>S;sp3 、sp2;
(4)1个[Cu(NH3)4]SO4中,有4个NH3,1个NH3中有3个σ键;共含有4×3=12个σ键;1个SO42-中含有4个σ键;1个铜原子与4个NH3形成4个配位键,即有4个σ键;因此1 moI[Cu(NH3)4]SO4中含有σ键的数目为20NA;综上所述,本题答案是:20NA。
(5)由晶胞图可知,一个晶胞中,Cu原子的数目为12×1/4=3,N原子的数目为8×1/8=1,因此该晶体的化学式为Cu3N;1mol 晶胞的质量为64×3+14=206g,一个晶胞的体积V=(a×10-7)3cm3,因此晶体的密度=206÷[NA×(a×10-7)3]= 206÷[NA×a3×10-21]= 206×1021/(NA×a3) g/cm3;
综上所述,本题答案是:Cu3N;206×1021/(NA×a3)。


科目:高中化学 来源: 题型:
【题目】现有一混合物的水溶液,可能含有以下离子中的几种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 现取三份各100mL溶液进行如下实验: 第一份加入
现取三份各100mL溶液进行如下实验: 第一份加入![]() 溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到
溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到![]() 气体;第三份加足量
气体;第三份加足量![]() 溶液后,得到干燥沉淀
溶液后,得到干燥沉淀![]() ,经足量盐酸洗涤、干燥后,沉淀质量为
,经足量盐酸洗涤、干燥后,沉淀质量为![]() 。你认为以下结论正确的是
。你认为以下结论正确的是
A. 该混合液中一定含有:![]() 、
、![]() 、
、![]() 、
、![]() ,可能含
,可能含![]() ,且
,且![]()
B. 该混合液中一定含有:![]() 、
、![]() 、
、![]() ,可能含
,可能含![]() 、
、![]()
C. 该混合液中一定含有:![]() 、
、![]() 、
、![]() ,可能含
,可能含![]() 、
、![]() 、
、![]()
D. 该混合液中一定含有:![]() 、
、![]() ,可能含
,可能含![]() 、
、![]() 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想已成为现实。某化学兴趣小组在实验室中模拟上述过程(反应缓慢不发生爆炸),其设计的模拟装置如下:
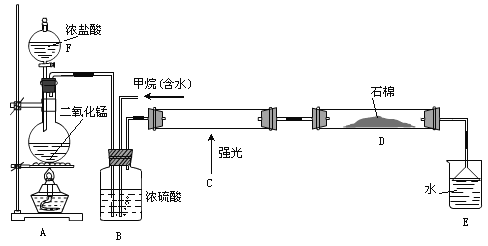
根据要求填空:
(1)仪器F的名称______________;A中反应的离子反应方程式___________________。
(2)B装置有三种功能:①控制气流速度;②均匀混合气体③______________________。
(3)为了除多余的氯气,D装置中的石棉网均匀附着KI粉末,你认为能否换成碱石灰______(填“能”或“不能”)。
(4)E装置的作用________。
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(5)E装置中除了盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1 mol·L1稀盐酸,CO2的生成量与加入盐酸的体积的关系如图。下列判断正确的是
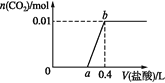
A. 在0~a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:![]()
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 和
和![]() 可以相互转化
可以相互转化![]()
![]() 。现将一定量
。现将一定量![]() 和
和![]() 的混合气体通入体积为1L的恒温恒容的密闭容器中,反应物浓度随时间变化关系如图。下列说法不正确的是
的混合气体通入体积为1L的恒温恒容的密闭容器中,反应物浓度随时间变化关系如图。下列说法不正确的是
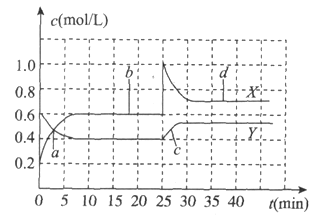
A. 反应进行至25min时,曲线发生变化的原因是加入0.4mol![]()
B. a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d
C. 图中共有两条曲线X和Y,其中曲线X表示![]() 浓度随时间的变化
浓度随时间的变化
D. 若要达到与d相同的状态,在25min时还可以采取的措施是适当缩小容器体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①写出乙炔的结构式________________;②写出水玻璃中溶质的化学式________________。
(2)写出二氧化锰与浓盐酸共热反应的化学方程式:___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com