
关于下图所示转化关系(X代表卤素),说法不正确的是

A.2H(g) +2X(g) == 2HX(g) ΔH3<0
B.途径Ⅰ生成HX的反应热与途径无关,所以ΔH1 = ΔH2 + ΔH3
C.Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多
D.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年天津市和平区高三下学期第一次质量调查化学试卷(解析版) 题型:选择题
一种新型的乙醇电池,它用磺酸类质子溶剂。电池总反应为:C2H5OH +3O2 → 2CO2 +3H2O,电池示意如下图,下列说法正确的是
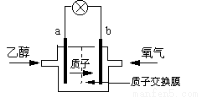
A.a极为电池的正极
B.电池工作时电流由a极沿导线经灯泡再到b极
C.电池负极的电极反应为:4H+ + O2 + 4e- = 2H2O
D.电池工作时,1mol C2H5OH被氧化时有12mol e-转移
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
用无机矿物资源生产部分材料,其产品流程示意图如下。下列有关说法不正确的是
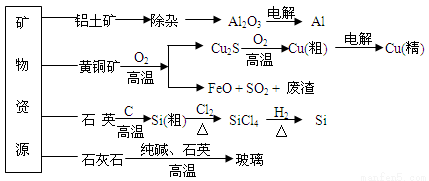
A.制取玻璃的同时产生CO2气体,制取粗硅时生成的气体产物为CO
B.生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应
C.粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法
D.黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省六校高三第二次联考理综化学试卷(解析版) 题型:选择题
用NA表示阿伏加徳罗常数的值,下列说法正确的是
A.常温常压下,2.24L 氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.1NA
B.25℃时,2L0.1mol/L的Na2CO3溶液中含有的CO32-总数为0.2 NA
C.某密闭容器中盛有0.2molSO2和0.1molO2,在一定条件下充分反应,生成SO3分子数为0.2 NA
D.30g乙酸和甲醛的混合物中氧原子数为NA
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省松原市高一下学期第一次月考化学试卷(解析版) 题型:选择题
现有5种短周期元素X、Y、Z、Q、W,原子序数依次增大,在周期表中X原子半径最小;X和W同主族;Y元素原子核外电子总数是其次外层电子数的3倍;Q元素是地壳中含量最高的元素。下列说法不正确的是
A.原子半径:Y<Q<W
B.ZX3可使紫色石蕊溶液变蓝
C.X、Z、Q3种元素可组成离子化合物或共价化合物
D.X2Q2、Y2X62种分子中含有的电子数、化学键种类都相同
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省松原市高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列各项表达中正确的是
A.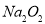 的电子式为
的电子式为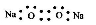
B.16g甲烷完全燃烧生成的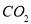 为11.2L(标准状况)
为11.2L(标准状况)
C.在氮原子中,质子数为7而中子数不一定为7
D.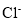 的结构示意图为
的结构示意图为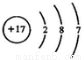
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省松原市高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.中子数为20的氯原子: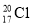
B.四氯化碳的电子式: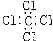
C.铝原子的结构示意图:
D.二氧化碳的结构式:O—C—O
查看答案和解析>>
科目:高中化学 来源:2014-2015上海市奉贤区高三第二学期调研测试化学试卷(解析版) 题型:选择题
下列有关Fe2(SO4)3溶液的叙述正确的是
A.该溶液中,K+、Fe2+、I—、Br—可以大量共存
B.用该溶液中溶解一定量铜粉,向所得溶液中再加入铁粉,若溶液中有Cu2+,则一定没有固体析出
C.将该溶液蒸干,得到的固体中混有氢氧化铁
D.100mL 0.1 mol/L该溶液和足量的Zn充分反应,生成1.12 gFe
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省张掖市高三4月诊断考试理综化学试卷(解析版) 题型:简答题
【化学——选修2:化学与技术】(15分)将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺流程提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是________(填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁等的提取工艺
(2)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收。溴歧化为Br-和BrO3-并没有产生CO2则反应的离子反应方程式为 。
(3)海水提镁的一段工艺流程如下图:
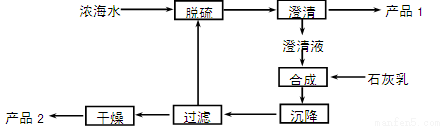
浓海水的主要成分如下:
离子 | Na+ | Mg2+ | Cl- | SO42- |
浓度/(g·L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
该工艺过程中,脱硫阶段主要反应的阳离子_______,获得产品2的离子反应方程式为 ,浓海水的利用率为90%,则1 L浓海水最多可得到产品2的质量为________g。
(4)由MgCl2·6H2O制备MgCl2时,往往在HCl的气体氛围中加热。其目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com