
| A. | 气态氢化物的稳定性:D>C | |
| B. | 原子序数:B>A>C>D | |
| C. | 最高价氧化物对应水化物的碱性:B>A | |
| D. | 四种元素一定都属于短周期元素 |
分析 An+、B(n+1)+、Cn-、D(n+1)-具有相同的电子层结构,则A、B为金属、C、D为非金属,且C、D位于A、B的上一个周期,同周期原子序数越大,金属性越弱、非金属性越强,以此来解答.
解答 解:A.C、D均为非金属,C的电荷数小、原子序数大,非金属性C>D,则气态氢化物的稳定性:D<C,故A错误;
B.C、D位于A、B的上一个周期,同周期的最外层电子数越大,原子序数越大,则原子序数:B>A>C>D,故B正确;
C.金属性A>B,则最高价氧化物对应水化物的碱性:B<A,故C错误;
D.若n=1,A、B可能为第四周期的K、Ca,而C、D为第三周期的Cl、S,故D错误;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、原子序数及元素周期律为解答的关键,侧重分析与应用能力的考查,注意具有相同电子排布的离子在周期表的位置,题目难度不大.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 操作方法 |
| A | 除去溴苯中的溴 | 将混合物倒入分液漏斗中,加入苯,充分振荡,静置,分液 |
| B | 制备氢氧化铁胶体 | 在氢氧化钠溶液中加入饱和FeCl3溶液,煮沸 |
| C | 除去Cl2中少量HCl | 将混合气体通过盛有饱和碳酸氢钠溶液的洗气瓶 |
| D | 验证CH3COONa溶液中存在水解平衡 | 取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体(其水溶液呈中性),观察溶液颜色变化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用Cu+2FeCl3=CuCl2+2FeCl2反应,设计一个原电池并写出电极反应式画出示意图.
利用Cu+2FeCl3=CuCl2+2FeCl2反应,设计一个原电池并写出电极反应式画出示意图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
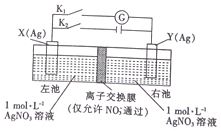
| A. | 闭合K2,断开Kl一段时间后,X电极质量增加 | |
| B. | 闭合K2,断开Kl一段时间后,右池c(AgNO3)增大 | |
| C. | 断开K2,闭合K1,X 电极发生氧化反应 | |
| D. | 断开K2,闭合K1,NO3-从左池向右池移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C6H14O的醚有15种 | |
| B. | 将气体通过酸性高锰酸钾溶液可提纯含有乙烯杂质的乙烷 | |
| C. | 分馏、干馏都属于物理变化,裂化、裂解都属于化学变化 | |
| D. | 聚乙烯、橡胶、聚酯纤维都是通过加聚反应制得的高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
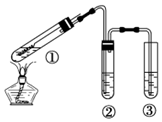
| A. | ②中选用品红溶液验证SO2的生成 | |
| B. | ③中选用NaOH溶液吸收多余的SO2 | |
| C. | 为确认有CuSO4生成,向①中加水,观察颜色 | |
| D. | 上下移动①中铜丝可控制SO2的产生与停止 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com