
 ͭ���ء��������Ԫ�صĻ�����������������̫���ܵ�ص���Ҫ���ϣ���ش�
ͭ���ء��������Ԫ�صĻ�����������������̫���ܵ�ص���Ҫ���ϣ���ش�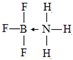 ��
������ ��1������Ԫ�ط��ţ��ж�Ԫ��ԭ�ӵĺ�����������ٸ��ݺ�������Ų�������д��Cu+�ĺ�����28�����ӣ����ݹ���ԭ����д���̬���Ӻ�������Ų�ʽ��ԭ�ӹ������ȫ�ա�������ȫ��ʱ���ȶ���
��2���������������Ԫ���γ���̬�⻯��ֱ�ΪH2Se��SiH4������ӽṹ�ֱ���H2O��CH4���ƣ�����Si-H���м��ϵ���ƫ����ԭ�ӣ�˵���������ۣ�����������Ӧʱ�������������������Ը��ۣ�
��3�����ݷ��Ӿ�����ۡ��е�ͣ����ݼ۲���ӶԻ�������ȷ���ӻ����ͣ�
��4����Ԫ����Ԫ�����ڱ��е�λ���ǵ������ڵڢ�A�壬�ṩ�չ����ԭ�Ӻ��ṩ�µ��ӶԵ�ԭ��֮���γ���λ����
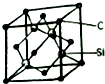
��5��ÿ��̼ԭ������4����ԭ�ӣ�ÿ����ԭ������������3��̼ԭ�ӣ��ݴ��ж�ÿ��Cԭ����Χ�����Cԭ����Ŀ���þ�����Cԭ�Ӹ���=8��$\frac{1}{8}$+6��$\frac{1}{2}$=4��Siԭ�Ӹ���Ϊ4�����ݦ�=$\frac{m}{V}$�������ܶȣ�
��� �⣺��1��CuԪ��Ϊ29��Ԫ�أ�ԭ�Ӻ�����29�����ӣ����Ժ�������Ų�ʽΪ��1s22s22p63s23p63d104s1��[Ar]3d104s1��CuO��ͭ�ļ۲�����Ų�Ϊ3d94s0��Cu2O��ͭ�ļ۲�����Ų�Ϊ3d10��3d10Ϊ�ȶ��ṹ�������ڸ���ʱ��������Cu2O�����ȶ�����CuO��Cu2O��
�ʴ�Ϊ��1s22s22p63s23p63d104s1��[Ar]3d104s1������
��2���������������Ԫ���γ���̬�⻯��ֱ�ΪH2Se��SiH4������ӽṹ�ֱ�V�Σ��������壻����Si-H���м��ϵ���ƫ����ԭ�ӣ�˵���������ۣ�����������Ӧʱ�������������������Ը��ۣ����������ĵ縺����Դ�СΪSe��Si��
�ʴ�Ϊ��V�Ρ��������壻����
��3��SeO2�����°�ɫ���壬�ۡ��е�ͣ�Ϊ���Ӿ��壻�������������м۲���Ӷ�=2+$\frac{1}{2}$��6-2��2��=3��Seԭ�ӵ��ӻ�����Ϊsp2���Һ���һ���µ��Ӷԣ���������V�Σ�
�ʴ�Ϊ�����Ӿ��壻sp2��
��4����Ԫ����Ԫ�����ڱ��е�λ���ǵ������ڵڢ�A�壬BF3•NH3��Bԭ�Ӻ���3���� ����1����λ����������۲��������4��Bԭ�Ӳ�ȡsp3�ӻ����û������У�Bԭ���ṩ�չ����ԭ�ӡ�Nԭ���ṩ�µ��Ӷԣ�B��Nԭ��֮���γ���λ������ṹ��ʽ�ɱ�ʾΪ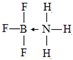 ��
��
�ʴ�Ϊ���������ڵڢ�A�壻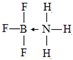 ��
��
��5��ÿ��̼ԭ������4����ԭ�ӣ�ÿ����ԭ������������3��̼ԭ�ӣ�����ÿ��Cԭ����Χ�����Cԭ����ĿΪ3��4=12���þ�����Cԭ�Ӹ���=8��$\frac{1}{8}$+6��$\frac{1}{2}$=4��Siԭ�Ӹ���Ϊ4�������߳�=a��10-10cm�����V=��a��10-10cm��3����=$\frac{m}{V}$=$\frac{\frac{40��4}{{N}_{A}}}{��a��1{0}^{-10}��^{3}}$g•cm3=$\frac{1.6��1{0}^{32}}{{N}_{A}}$g•cm3��
�ʴ�Ϊ��12��$\frac{1.6��1{0}^{32}}{{N}_{A}}$��
���� ���⿼�����ʽṹ�����ʣ��漰�������㡢ԭ���ӻ��жϡ�ԭ�Ӻ�������Ų�ʽ����д��֪ʶ�㣬�ѵ��Ǿ������㣬��Ŀ�ѶȽϴ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
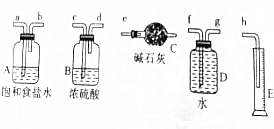
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
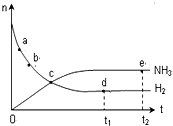 �����ܱ������еķ�Ӧ��N2��g��+3H2��g��?2NH3��g������673K��30MPa�£�n��NH3����n��H2����ʱ��ı仯��ϵ����ͼ��ʾ������˵����ȷ���ǣ�������
�����ܱ������еķ�Ӧ��N2��g��+3H2��g��?2NH3��g������673K��30MPa�£�n��NH3����n��H2����ʱ��ı仯��ϵ����ͼ��ʾ������˵����ȷ���ǣ�������| A�� | ��a������Ӧ���ʱȵ�b�Ĵ� | |
| B�� | ��c����Ӧ�ﵽƽ�� | |
| C�� | ��d ��t1ʱ�̣��͵�e ��t2ʱ�̣���n��N2����һ�� | |
| D�� | ����ʼ����1mol N2������H2���ṩ�ʵ��������ɵ�2mol NH3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 64gCu��������ʧȥ�ĵ�����һ��Ϊ2NA | |
| B�� | �����£�pH=13�İ�ˮ�У���ˮ�����OH-��Ϊ0.1NA | |
| C�� | �ڱ�״���£�22.4LC4H10�й��ۼ���ĿΪ13NA | |
| D�� | 200mL1mol/LFe2 �� SO4��3 ��Һ�У�SO42-��������0.3NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ij�о���ѧϰС�������һ��ʵ����֤Ԫ�������ɣ�
ij�о���ѧϰС�������һ��ʵ����֤Ԫ�������ɣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ���ʵ�� | Ԥ��Ŀ�� | |
| A | ��ͬ�¶��£����������Ĵ���ʯ�顢����ʯ��ĩ�ֱ������������Ũ�ȵ�����ʹ����У��۲����ݲ����Ŀ��� | ��֤����Ӵ�����Ի�ѧ��Ӧ���ʵ�Ӱ�� |
| B | ���淴ӦFeCl3��aq��+3KSCN��aq��?Fe��SCN��3��aq��+3KCl��aq������ƽ�����������������ʱ������KCl���壬�۲���ϵ��ɫ�ı仯 | ��֤Ũ�ȶԻ�ѧƽ���Ӱ�� |
| C | �����£���BaSO4����Һ�м��뱥��Na2CO3��Һ�����˺���������м������ᣬ���������ܽ� | ��֤BaSO4��BaCO3��Ksp����Դ�С |
| D | ��ͬ�¶��£���֧�Թ���װ�е��������Ũ�ȵ�H2O2��Һ�������зֱ��������FeCl3�����������MnO2���� | ��֤��ͬ������H2O2�ֽ����ʵ�Ӱ�� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
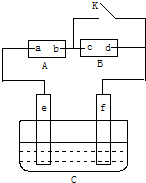 ��ͼ��AΪֱ����Դ��BΪ�������Ȼ�����Һ�ͷ�̪��Һ����ֽ��CΪ��Ʋۣ���ͨ��·����B�ϵ�c���Ժ�ɫ������գ�
��ͼ��AΪֱ����Դ��BΪ�������Ȼ�����Һ�ͷ�̪��Һ����ֽ��CΪ��Ʋۣ���ͨ��·����B�ϵ�c���Ժ�ɫ������գ��鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com