

分析 (1)A、B、C、D四种短周期主族元素,其原子序数依次增大,A、B可形成A2B和A2B2两种化合物,可能为H2O、H2O2或Na2O、Na2O2,则A为H元素,B为O元素,B、C同主族且可形成CB2和CB3两种化合物,应为SO2和SO3,则C为S元素,D应为Cl元素;
(2)非金属性强的非金属单质可以置换出非金属性弱的非金属单质,据此写化学方程式;
(3)CB2通入A2B2溶液中可被氧化为W,则W为H2SO4;
(4)金属元素E是中学化学常见元素,位于元素周期表的第四周期,该元素可与D形成ED2和ED3两种化合物,则E为Fe元素,Fe与氯化铁反应生成氯化亚铁;
(5)石墨--铁在氯化铁电解质溶液中形成原电池,石墨为正极,Fe3+在正极获得电子生成Fe2+,Fe为负极,发生氧化反应生成Fe2+,电子由负极经导线流向正极.
解答 解:A、B、C、D四种短周期主族元素,其原子序数依次增大,A、B可形成A2B和A2B2两种化合物,可能为H2O、H2O2或Na2O、Na2O2,则A为H元素,B为O元素,B、C同主族且可形成CB2和CB3两种化合物,应为SO2和SO3,则C为S元素,D应为Cl元素,
(1)由上述分析可知,C为硫元素,故答案为:硫;
(2)非金属性强的非金属单质可以置换出非金属性弱的非金属单质,根据反应Cl2+H2S=S+2HCl可知,非金属性S<Cl,
故答案为:Cl2+H2S=S+2HCl;
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期,该元素可与D形成ED2和ED3两种化合物,则E为Fe元素,Fe与氯化铁反应生成氯化亚铁,该反应离子方程式为:Fe+2Fe3+=3Fe2+,
故答案为:Fe+2Fe3+=3Fe2+;
(4)石墨--铁在氯化铁电解质溶液中形成原电池,石墨为正极,Fe3+在正极上得电子被还原,电极反应式为:2Fe3++2e-=2Fe2+,铁做负极,负极反应式为Fe-2e-=Fe2+,电子由负极经导线流向正极,该原电池装置图为: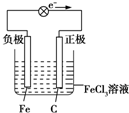 ,故答案为:Fe-2e-=Fe2+;
,故答案为:Fe-2e-=Fe2+; .
.
点评 本题考查元素推断和原电池、常用化学用语,题目难度中等,注意正确推断元素的种类为解答该题的关键,注意原电池装置图的绘画.


 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:解答题
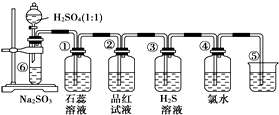 如图是实验室制备SO2并验证SO2某些性质的装置图.
如图是实验室制备SO2并验证SO2某些性质的装置图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测定序号 | 待测溶液的体积/mL | 所耗盐酸标准液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.52 |
| 2 | 20.00 | 1.20 | 21.18 |
| 3 | 20.00 | 0.80 | 24.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对空气进行降温加压 | B. | 金刚石变成石墨 | ||
| C. | NaCl熔化 | D. | 碘溶于CCl4中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
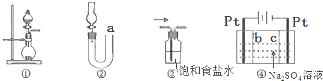
| A. | 图①可用于实验室制取少量NH3或O2 | |
| B. | 可用从a处加水的方法检验图②装置的气密性 | |
| C. | 实验室可用图③的方法除去Cl2中混有的HCl | |
| D. | 利用图④装置制硫酸和氢氧化钠,其中b为阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
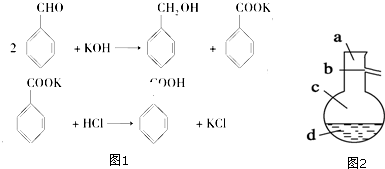
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
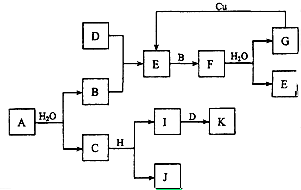 A~K为中学化学的常见物质,它们之间有如下图所示的转化关系(反应条件已略去).已知:通常状况下,A是淡黄色固体,B、D和I都是无色气体单质,F是红棕色气体,H是金属单质.回答下列问题:
A~K为中学化学的常见物质,它们之间有如下图所示的转化关系(反应条件已略去).已知:通常状况下,A是淡黄色固体,B、D和I都是无色气体单质,F是红棕色气体,H是金属单质.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com