
我国药物化学家屠吆吆用乙醚提取青蒿素,得到具有高效抗疟作用青蒿素,为此获得 2015 年诺贝尔生理学或医学奖的一半授予。以异胡薄荷醇为起始原料是人工全合成青蒿素的途径之一(如图)。 下列说法不正确的是
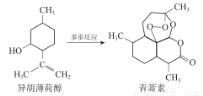
A.异胡薄荷醇可以与溴水发生加成反应
B.异胡薄荷醇含有一个苯环结构
C.青蒿素易溶于乙醚
D.青蒿素分子中碳氧原子个数比3:1
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源:2015-2016学年河北省高一下期中化学试卷(解析版) 题型:选择题
将11.2g铜粉和镁粉的混合物分成两等份,其中一份加入200mL的稀硝酸中并加热,固体和硝酸恰好完全反应,并产生标准状况下的NO2.24L;将另一份在空气中充分加热,最后得到mg固体。下列有关说法:①c(HNO3)=2mol·L-l②c(HNO3)=0.5mol·L-1③m=8.0④m=7.2其中正确的是( )
A.①④ B.①③ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三第九次月考化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是
A.硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓
B.NaHCO3溶液中加入过量的 Ba(OH)2溶液:HCO3-+Ba2++OH-= BaCO3↓+H2O
C.氯化铝溶液中加入过量氨水 Al3++ 4NH3•H2O=AlO2-+ 4NH4++2H2O
D.用稀HNO3溶液FeS固体:FeS+2H+=Fe2++H2S↑
查看答案和解析>>
科目:高中化学 来源:2016届海南中学高三高考模拟九化学试卷(解析版) 题型:实验题
某研究性小组借助下列仪器装置,验证Ag与浓硝酸反应的过程中可能产生NO。从图装置C取25.00mL 待测溶液放入锥形瓶中,并滴加2 ~3滴酚酞作指示剂。用0.10 mol/ L NaOH的标准液进行滴定,到终点时,消耗NaOH溶液2.00mL。 根据此回答下列问题:
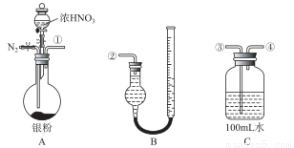
(1)滴定达到终点的标志是__________________________________;
(2)C中溶液硝酸的物质的量浓度为______________; Ag 与浓硝酸反应过程中生成标准状况下的NO2体积为_______mL。
(3)用上图所示仪器,组合一套用水吸收生成的 NO2,测定生成NO体积的装置,其合理的连接顺序是___________(填各导管的编号)。 反应前,先通入N2目的是___________________;
(4)在测定NO的体积时,B装置右边细管中液面比左边的液面高,此时应将B装置中的右边细管位置____________(“下降”或“升高”),以保证B装置中两边液面持平。
(5)若实验测得NO的体积为112.0mL(已折算到标准状况),则Ag与浓硝酸反应的过程中________(填“有”或“没有”)NO 产生,作此的依据是___________________;
查看答案和解析>>
科目:高中化学 来源:2016届海南中学高三高考模拟九化学试卷(解析版) 题型:选择题
人工模拟光合作用,设计的电化学实验装置如图,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是
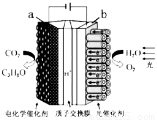
A.该装置将化学能转化为光能和电能
B.该装置工作时,H+从b极区向a极区迁移
C.该转化过程中,水得到电子
D.反应为6CO2+8H2O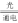 2C3H8O+9O2
2C3H8O+9O2
查看答案和解析>>
科目:高中化学 来源:2016届海南中学高三高考模拟八化学试卷(解析版) 题型:实验题
某工厂的废渣中含NaCl、Mg ( OH) 2、CaCO3、BaCO3等,为实现变废为宝,设计了以下工艺流程制备七水硫酸镁。
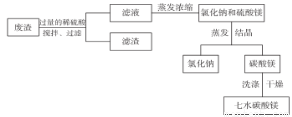
在废渣中加入过量的稀硫酸,控制 pH为5.0,温度在52℃左右,用搅拌器持续搅拌。
(1)搅拌的作用是为使反应充分进行,其化学原理为_____________________________;
(2)经过分析,过滤所得滤液中含有的离子的主要为 Na+、Mg2+、H+、SO42-、Cl-,为了除去H+,最好加入适量的_____________________________ (填化学式)。
(3)蒸发浓缩器的溶液中主要含有氯化钠和硫酸镁,通入高温水蒸汽并控制温度在100 ~ 110℃,蒸发浓缩结晶,此时析出的晶体主要是氯化钠,说明此温度下硫酸镁的溶解度比氯化钠____________ (“大”或“小”)。 结晶槽中硫酸镁结晶的方法为_______________。
(5)为了检验所得 MgSO4·7H2O 是否纯净,具体的操作为____________。
查看答案和解析>>
科目:高中化学 来源:2016届海南中学高三高考模拟八化学试卷(解析版) 题型:简答题
甲烷的用途很广泛。
(1)已知:
2NO2(g ) N2O4(g) △H= -56.9kJ·mol -1
N2O4(g) △H= -56.9kJ·mol -1
H2 O(g)= H2O(l) △H= -44.0kJ·mol -1
CH4(g)+N2O4 (g)= N2(g)+2H2O(l)+CO2 (g) △H=-898.1kJ·mol -1
则 CH4 (g)催化还原NO2 (g)生成 N2(g)和H2O(g)的热化学方程式为_____________________。
(2)一定条件下,发生2NO(g)+2CO(g) N2(g) +2CO2(g) △H<0。在不同时间c(NO)与c(CO)如下表所示:
N2(g) +2CO2(g) △H<0。在不同时间c(NO)与c(CO)如下表所示:
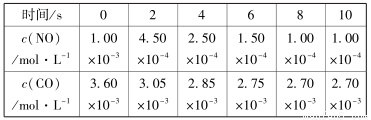
①该温度下,该反应的平衡常数表达式为K =_____________________;
②计算前4秒内氮气的平均反应速率为____________________;
③下列选项中,不能说明上述反应已达平衡的是( )
A.2v正(NO)= v逆(N2 )
B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中CO的质量不再发生变化
E. 容器中气体的总压强不随时间而变化
(3)CH4燃料电池原理如图所示
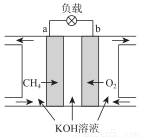
①该燃料电池的正极为_______________(填“a”或“b”)。该电池负极的电极反应式为_____________;
②放电一段时间后,电解质溶液的pH___________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2016届青海省西宁市等校高三下联考理综化学试卷(解析版) 题型:填空题
【化学—物质结构与性质】原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29。
(1)F原子基态的外围核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是 (用元素符号回答)。
(3)元素B的简单气态氢化物的沸点 (高于,低于)元素A的简单气态氢化物的沸点,其主要原因是 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。
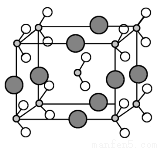
(7)FC在加热条件下容易转化为F2C,从原子结构的角度解释原因 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江双鸭山一中高二下期中化学试卷(解析版) 题型:选择题
金银花是治疗和预防甲型H1N1的常见中草药,有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构式见图,下列有关绿原酸的说法不正确的是( )
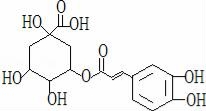
A.分子式为C16H18O9
B.含有羧基、羟基、酯基等含氧官能团
C.1mol绿原酸最多与5mol H2加成
D.1mol绿原酸最多与4mol NaOH反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com