
少量二氧化碳通入NaCN溶液中,发生如下反应:CO2 + H2O + CN- =HCO3- + HCN。以下说法正确的是(温度均为25℃)
A.电离常数:K(HCN) <Ka2 (H2CO3)
B.浓度均为0.1mol·L-1的NaCN和NaHCO3溶液的pH:NaCN <NaHCO3
C.浓度均为0.1mol·L-1的NaCN和Na2CO3溶液中,阴离子总浓度相等
D.pH均为10的 Na2CO3溶液、NaCN溶液中,水电离产生的c(OH-)相等
D
【解析】
试题分析:根据强酸制取弱酸的反应原理。少量二氧化碳通入NaCN溶液中,发生如下反应:CO2 + H2O + CN- =HCO3- + HCN。则酸性H2CO3>HCN> HCO3-。A.在相同的温度下电离平衡常数就越大,溶液的酸性越强。电离常数:K(HCN) > Ka2 (H2CO3).错误。B.对于弱酸来说,酸性越强,其水解的程度就越小。由于酸性:H2CO3>HCN。所以浓度均为0.1mol·L-1的NaCN和NaHCO3溶液的pH:NaCN > NaHCO3。错误。C.在溶液中会发生水解反应。H2O + CN- HCN+OH-.CO32- +H2O
HCN+OH-.CO32- +H2O HCO3-+OH-;HCO3-+H2O
HCO3-+OH-;HCO3-+H2O H2CO3+OH-由于CO32- 水解的程度大,产生的都是阴离子,而CN-水解的程度小。水解消耗的阴离子与产生的阴离子数目相等。所以阴离子总浓度Na2CO3溶液大。错误。D.Na2CO3和NaCN都是盐,水解使溶液显碱性。若溶液的pH相等,则水电离产生的c(OH-)相等。正确。
H2CO3+OH-由于CO32- 水解的程度大,产生的都是阴离子,而CN-水解的程度小。水解消耗的阴离子与产生的阴离子数目相等。所以阴离子总浓度Na2CO3溶液大。错误。D.Na2CO3和NaCN都是盐,水解使溶液显碱性。若溶液的pH相等,则水电离产生的c(OH-)相等。正确。
考点:考查盐水解的规律及离子浓度的大小比较、与弱酸的电离平衡常数的关系的知识。


科目:高中化学 来源:2016届吉林省高一教学评估(一)化学试卷(解析版) 题型:填空题
(1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气,写出该反应的离子方程式 ;
(2)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。 漂白粉是常用的消毒剂。工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为 ;
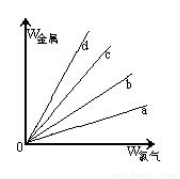
(3)在下图的四条直线分别表示钠、铜、铝、铁与足量Cl2反应时,消耗金属的质量(纵轴)与反应掉的氯气质量(横轴)的关系,其中代表铁与Cl2反应的直线是 ,如果横轴表示消耗掉的硫的质量,则b表示的是四种金属中的 。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高一上学期期末质量检测化学试卷(解析版) 题型:选择题
海水淡化的研究已经有很长时间的历史了,通过海水淡化可以部分解决淡水紧缺的问题。下列可以实现海水淡化的实验操作是
A.过滤 B.蒸发 C.蒸馏 D. 萃取
查看答案和解析>>
科目:高中化学 来源:2016届云南省高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列存在丁达尔现象的分散系是( )
①有尘埃的空气
②溴水
③蒸馏水
④沸水中加入适量饱和FeCl3的溶液至溶液变为透明的红褐色液体
⑤淀粉的溶液
A.①②③⑤ B.①④⑤ C.②③ D.②③⑤
查看答案和解析>>
科目:高中化学 来源:2015届福建省龙岩市高二第一学期教学质量检测化学试卷(解析版) 题型:填空题
KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去。某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响。该实验条件作如下限定:
①所用KMnO4酸性溶液的浓度可选择:0.02 mol·L-1、0.002 mol·L-1;
②所用H2C2O4溶液的浓度可选择:0.2 mol·L-1、0.4 mol·L-1;
③每次实验时KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液的用量均为2mL。
(1)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成____ 组实验进行对比即可得出结论。
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如下表所示:
KMnO4酸性溶液浓度 (mol·L-1) | 溶液褪色所需时间(min) | |||
第一次 | 第二次 | 第三次 | ||
0.02 | 14 | 13 | 11 | |
0.002 | 6.7 | 6.6 | 6.7 | |
①用0.002 mol/L KMnO4酸性溶液进行实验时,KMnO4的平均反应速率(忽略混合前后溶液体积变化)。
②依据表中数据,不能得出“溶液的褪色所需时间越短,反应速率越快”的结论。某同学设计以下方案,可以直接得出“褪色时间越短,反应的速率越快”结论。
KMnO4酸性溶液 | H2C2O4溶液 | ||
浓度/ mol/L | 体积(ml) | 浓度/ mol/L | 体积(ml) |
0.02 | 2 | b | 4 |
a | 2 | c | 4 |
则表中a= ;b= ;c= 。
(3)草酸电离常数:Ka1=5.9×10-2,Ka2=6.4×10-5。与KMnO4反应时,它将转化为CO2和H2O。
①草酸与酸性高锰酸钾溶液反应的离子方程式为 。
②室温下,0.1mol·L-1 KHC2O4酸溶液中pH 7,理由是 。
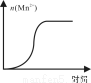
(4)测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图。请解释n(Mn2+)在反应起始时变化不大、一段时间后快速增大的原因: 。
查看答案和解析>>
科目:高中化学 来源:2015届福建省龙岩市高二第一学期教学质量检测化学试卷(解析版) 题型:选择题
已知:25℃时,Ka(HAc)=1.7×10-5 mol /L。现有如下溶液:
①0.1mol/LHAc与0.1mol/LNaOH溶液等体积混合液
②pH = 3的HAc与pH = 11的NaOH溶液等体积混合液
③0.1 mol /LH2SO4与0.2mol/LNaOH溶液等体积混合液
常温时,三者pH大小关系正确的是
A.①>③>② B.③>①>② C.①>②>③ D.②>③>①
查看答案和解析>>
科目:高中化学 来源:2015届福建省龙岩市高二第一学期教学质量检测化学试卷(解析版) 题型:选择题
已知化学反应A2(g) + B2(g) = 2AB(g)的能量变化如图所示,下列叙述正确的是
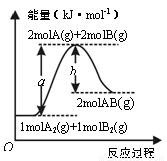
A.每生成2分子AB吸收bkJ热量
B.该反应热△H=(b -a)kJ·mol-1
C.反应物的总能量低于生成物的总能量
D.断裂1molA—A和1molB—B键,放出akJ能量
查看答案和解析>>
科目:高中化学 来源:2015届福建省四地六校高二下学期第一次月考化学试卷(解析版) 题型:选择题
已知某元素+3价离子的电子排布为:1s22s22p63s23p63d5,该元素在周期表中的位置正确的是( )
A.第三周期第Ⅷ族, B.第四周期第ⅤA族,
C.第三周期第ⅤB族, D.第四周期第Ⅷ族
查看答案和解析>>
科目:高中化学 来源:2015届湖北省黄石市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:2c(Na+) + c(CH3COOH) = c(CH3COO-) +2c(OH-)
B.Ksp(AgCl)>Ksp(AgI)由此可以判断AgCl(S) + I- = AgI(S) + Cl-能够发生
C.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
D.中和浓度与体积均相等的盐酸和醋酸溶液,消耗NaOH的物质的量不相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com