

分析 根据实验原理可知,用(NH4)2S2O8和氢氧化钠反应生成Na2S2O8,由于NH3能与Na2S2O8反应,所以实验中要用氮气把生成的氨气及明排出容器,生成的氨气可以用硫酸吸收,氨气极易溶于水,所以要用防倒吸装置,
(1)根据上面的分析可知,装置Ⅱ是吸收氨气尾气的;
(2)根据题意该反应是在55℃条件下进行,所以要用水浴加热;
(3)NH3能与Na2S2O8反应,所以要及时排出;\
(4)要想测定溶解度需要知道溶质的质量和溶剂的质量,研究温度对溶解度的影响,需要测定溶液的温度,综合考虑,研究Na2S2O8溶解度随温度变化情况,实验过程需要测定的数据溶液的温度、溶质的质量、水的质量或体积.
(5)取等量铜粉,分别加入少量等体积的硫酸铜溶液和水,再加入等量过硫酸钠溶液,观察现象,若加入硫酸铜溶液的反应快,说明Cu2+起了催化作用,反之,Cu2+不起作用.
(6)步骤iv是从分液漏斗中加入过硫酸钠溶液,为了使液体顺利流下,需要保持内外气压相等,所以依次打开c、b,加入适量Na2S2O3溶液后关闭b②如果NO被吸收,会导致三颈瓶内气压降低,量气管液面下降,所以能证明该方案可行的实验现象是加入Na2S2O8溶液后量气管液面下降.
解答 解:(1)根据上面的分析可知,装置Ⅱ是吸收氨气尾气的,
故答案为:吸收NH3;
(2)根据题意该反应是在55℃条件下进行,所以要用水浴加热,要用到温度计、酒精灯、盛热水浴的水槽,故选abc,
故答案为:abc;
(3)NH3能与Na2S2O8反应,所以要及时排出,所以需要持续通入N2的目的是使三颈烧瓶内产生的NH3及时排除,减少副反应①的发生,
故答案为:使三颈烧瓶内产生的NH3及时排除,减少副反应①的发生;
(4)要想测定溶解度需要知道溶质的质量和溶剂的质量,研究温度对溶解度的影响,需要测定溶液的温度,综合考虑,研究Na2S2O8溶解度随温度变化情况,实验过程需要测定的数据溶液的温度、溶质的质量、水的质量或体积.
故答案为:溶液的温度、溶质的质量、水的质量或体积
(5)取等量铜粉,分别加入少量等体积的硫酸铜溶液和水,再加入等量过硫酸钠溶液,观察现象,若加入硫酸铜溶液的反应快,说明Cu2+起了催化作用,反之,Cu2+不起作用.
故答案为:取等量铜粉,分别加入少量等体积的硫酸铜溶液和水,再加入等量过硫酸钠溶液,观察;
(6)①步骤iv是从分液漏斗中加入过硫酸钠溶液,为了使液体顺利流下,需要保持内外气压相等,所以依次打开c、b,加入适量Na2S2O3溶液后关闭b②如果NO被吸收,会导致三颈瓶内气压降低,量气管液面下降,所以能证明该方案可行的实验现象是加入Na2S2O8溶液后量气管液面下降.
故答案为:①依次打开c、b(加入适量Na2S2O3溶液后)关闭b;②加入Na2S2O8溶液后量气管液面下降.
点评 本题考查物质制备及性质实验的操作,明确制取的原理以及氯气的性质等是解题关键,题目综合性强,难度较大.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
| A. | 同族元素的氧化物不可能形成不同类型的晶体 | |
| B. | SiO2晶体网状结构的最小的环上,Si和O原子数之比为1:2 | |
| C. | 满足难溶于水,熔点高,固体不导电,熔化时导电的晶体为离子晶体 | |
| D. | 同分异构体中,燃烧热数值越大,该物质越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定管用水洗后,未用标准溶液润洗就装入标准溶液 | |
| B. | 用于取待测液的滴定管未用待测液润洗 | |
| C. | 在摇动锥形瓶的过程中不慎溅出了一小部分溶液 | |
| D. | 标准液读数时,滴定前仰视,滴定后俯视 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
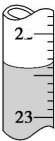 已知H2C2O4为二元中强酸.某化学兴趣小组为测定含Na2SO4、NaHC2O4和H2C2O4•2H2O的试样中各物质的质量分数,进行了如下实验:
已知H2C2O4为二元中强酸.某化学兴趣小组为测定含Na2SO4、NaHC2O4和H2C2O4•2H2O的试样中各物质的质量分数,进行了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)某研究性学习小组用一定物质的量浓度的盐酸滴定10.00mL一定物质的量浓度的NaOH溶液,滴定时使用pH计精确测量滴定过程中溶液的pH变化(温度为25℃),并绘制出滴定过程中溶液pH的变化曲线如图所示.实验过程中需要使用的仪器有铁架台、滴定管夹、酸式滴定管、碱式滴定管、锥形瓶、烧杯,由图可计算出标准HCl溶液的物质的量浓度为2.5mol/L(忽略溶液混合时的体积变化).
(1)某研究性学习小组用一定物质的量浓度的盐酸滴定10.00mL一定物质的量浓度的NaOH溶液,滴定时使用pH计精确测量滴定过程中溶液的pH变化(温度为25℃),并绘制出滴定过程中溶液pH的变化曲线如图所示.实验过程中需要使用的仪器有铁架台、滴定管夹、酸式滴定管、碱式滴定管、锥形瓶、烧杯,由图可计算出标准HCl溶液的物质的量浓度为2.5mol/L(忽略溶液混合时的体积变化).| 实验步骤 | 设计此步骤的目的 |
| 将配制的NaOH溶液加热 | 除去溶液中溶解的氧气 |
| 在加热后的溶液中滴加酚酞,并在上方滴加一些植物油 | 隔绝空气 |
| 实验方案 | 观察到的现象和结论 |
| 分别配制不同浓度的NaOH溶液,然后各滴加2~3滴酚酞溶液,较稀的NaOH溶液中出现红色,很浓的NaOH溶液中无红色出现(或先变红色,一会儿红色消失) | 说明红色消失与NaOH溶液的浓度有关(或:向原红色消失的溶液中慢慢加入足量的水,红色重新出现;说明红色消失与NaOH溶液的浓度有关) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


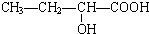 、
、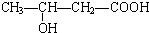 、
、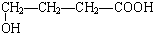
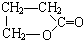 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com