
| A. | 离子化合物一定不含共价键 | B. | 化学键的形成与原子结构无关 | ||
| C. | 共价键只存在于共价化合物中 | D. | 离子键只存在于离子化合物中 |
分析 一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,含离子键的一定为离子化合物,共价键可存在于单质、化合物中,以此来解答.
解答 解:A.离子化合物中可含共价键,如NaOH含离子键、共价键,故A错误;
B.原子结构中最外层电子数可确定元素得到或失去电子,则化学键的形成与原子结构有关,故B错误;
C.共价键只存在于单质、共价化合物、离子化合物中,如氧气、NaOH、过氧化钠等均含共价键,故C错误;
D.含离子键的一定为离子化合物,则离子键只存在于离子化合物中,故D正确;
故选D.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | H2O是一种非常稳定的化合物,这是由于氢键所致 | |
| B. | 具有相同电子层结构的四种离子A+、B2+、C-、D2-,它们的半径由大到小的顺序是D2->C->A+>B2+ | |
| C. | 分子内部一定含有共价键 | |
| D. | 族序数等于周期序数的元素一定是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 1799年,科学家伏打(即伏特)以含食盐水的湿抹布,夹在铜和锌的圆木板中间,堆积成圆柱状,制造出最早的电池-伏特电池.下列说法不正确的是( )
1799年,科学家伏打(即伏特)以含食盐水的湿抹布,夹在铜和锌的圆木板中间,堆积成圆柱状,制造出最早的电池-伏特电池.下列说法不正确的是( )| A. | 该装置可以把化学能转化为电能 | |
| B. | 锌电极为负极 | |
| C. | 铜电极电极反应O2+2H2O+4e-=4OH- | |
| D. | 可用浸有酒精溶液的棉布代替浸有食盐水的棉布 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
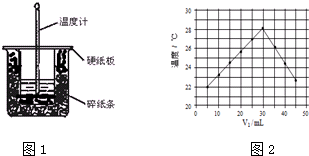
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.7 | 6.7 |
| 2 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
| 3 | 25.1 | 25.1 | 25.1 | 33.6 | 8.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
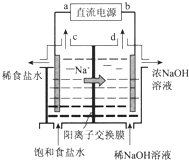 用石墨电极电解饱和NaCl溶液的装置如图所示,请回答:
用石墨电极电解饱和NaCl溶液的装置如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有KNO3,肯定没有Na2CO3 | B. | 肯定没有Ba(NO3)2,可能有KNO3 | ||
| C. | 肯定有KNO3,可能还有Na2CO3 | D. | 肯定没有Na2CO3和Ba(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
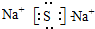 .
.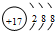 ,该元素的氢化物遇到氨气会产生大量的白烟,产生白烟的化学方程式为NH3+HCl=NH4Cl.
,该元素的氢化物遇到氨气会产生大量的白烟,产生白烟的化学方程式为NH3+HCl=NH4Cl.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
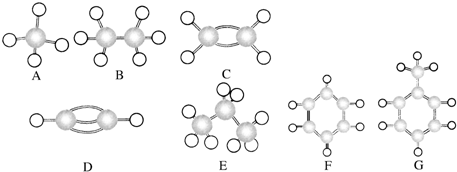
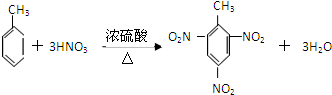 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com