
 .
.分析 A、B、C、D、E都是短周期元素,原子序数依次增大,E是地壳中含量最高的金属元素,则E为Al,C、D、E同处另一周期,结合原子序数可知C为Na、D为Mg;C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,则B为O,甲是Na2O,乙是Na2O2,D、A按原子个数比3:2形成离子化合物丙,则A为N元素,丙为Mg3N2,据此解答.
解答 解:A、B、C、D、E都是短周期元素,原子序数依次增大,E是地壳中含量最高的金属元素,则E为Al,C、D、E同处另一周期,结合原子序数可知C为Na、D为Mg;C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,则B为O,甲是Na2O,乙是Na2O2,D、A按原子个数比3:2形成离子化合物丙,则A为N元素,丙为Mg3N2.
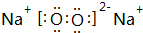
(1)B为O元素,在周期表中的位置是第二周期第ⅥA族,乙是Na2O2,电子式为 ,
,
故答案为:第二周期第ⅥA族; ;
;
(2)同周期从左向右原子半径在减小,同主族自上而下原子半径增大,则原子半径为O<N<Al<Mg<Na,
故答案为:O<N<Al<Mg<Na;
(3)E的单质为Al,A的最高价氧化物对应的水化物为HNO3,Al在浓硝酸中发生钝化现象,C的最高价氧化物对应水化物为NaOH,Al与氢氧化钠反应生成偏铝酸钠与氢气,反应的离子方程式是:2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:钝化;2Al+2OH-+2H2O═2AlO2-+3H2↑;
(4)丙与水反应生成两种碱性物质,该反应的化学方程式:Mg3N2+6H2O=3Mg(OH)2+2NH3 ,故答案为:Mg3N2+6H2O=3Mg(OH)2+2NH3 .
点评 本题考查位置结构性质关系应用,元素的推断是答题的关键,注意对基础知识的理解掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、Na+、SiO32-、NO3- | |
| B. | 0.1 mol•L-1 Na2CO3溶液:K+、Fe3+、NO3-、Cl- | |
| C. | 0.1 mol•L-1NaClO溶液:Na+、NH4+、SO32-、CO32- | |
| D. | 0.1 mol•L-1Na[Al(OH)4]溶液:K+、Na+、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 香烟烟气中只有尼古丁有毒 | |
| B. | 市售香烟通常装有过滤嘴,所以吸烟对人体无害 | |
| C. | 吸烟只影响自己的健康,不影响他人的健康 | |
| D. | 香烟烟气中的一氧化碳比氧气更容易与血红蛋白结合 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3 g钠与水反应产生氢气的分子数为0.05NA | |
| B. | 1 mol Fe与过量的稀HNO3反应,转移2NA个电子 | |
| C. | 0.1 mol/LNa2SO4溶液含有0.1NA个SO42- | |
| D. | 22.4 L氯气与足量铜充分反应,生成1 mol CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
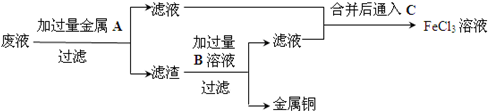
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图装置电解一段时间,当某极析出0.32gCu时,I、Ⅱ、Ⅲ中溶液pH分别为 (溶液足量,体积均为100mL且电解前后溶液体积变化及气体的溶解忽略不计)( )
如图装置电解一段时间,当某极析出0.32gCu时,I、Ⅱ、Ⅲ中溶液pH分别为 (溶液足量,体积均为100mL且电解前后溶液体积变化及气体的溶解忽略不计)( )| A. | 13、7、1 | B. | 12、7、2 | C. | 1、7、13 | D. | 7、13、1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
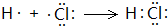 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com