
如图所示的装置中发生反应2A2(g)+B2(g)2C(g);△H=" -a" kJ/mol(a >0),已知P是可自由滑动的活塞。在相同温度时关闭K,向A, B容器中分别充入2mol A2和1mol B2两容器分别在500℃时达平衡,A中C的浓度为w1 mol/L,放出热量 b kJ,B中C的浓度为w2 mol/L,放出热量 c kJ。请回答下列问题:
(1)此反应的平衡常数表达式为______________________;若将温度升高到700℃,反应的平衡常数将_____________(增大、减小或不变)。
(2)比较大小:w1_____ w2(填>、=、<),a、b、c由大到小的关系 ______________________。
(3)若打开K,一段时间后重新达平衡,容器B的体积将______________________(填增大,减小或不变)。
(4)若让A,B体积相等且固定P,在B中改充入4mol A2和2mol B2,在500℃时达平衡后C 的浓度为w3 mol/L,则 w1,w3的关系______________________。
(5)能说明A中已达到平衡状态的是 (填序号,有一个或多个选项符合题意)。
a、v(C)=2v(B2)
b、容器内气体压强保持不变
c、容器中气体的平均相对分子质量不随时间而变化
d、容器内的气体密度保持不变
(6)使该反应的反应速率增大,且平衡向正反应方向移动的是_____________。
a、及时分离出C气体 b、适当升高温度
c、增大B2的浓度 d、选择高效的催化剂
(1).K= 减小
(2)< a >c > b
(3)减小 (4)w3 >2 w1
(5)b c (6)c
解析试题分析:(1)由平衡常数的定义可确定反应的平衡常数的表达式,又因为反应为放热反应,所以升高至7000C,平衡常数减小;(2)因为A容积固定,随反应进行压强减小,而B容积可变,压强始终保持不变,所以B中有利于反应的进行,w1< w2,且可知放出的热量a >c > b,(3)若打开K,一段时间后重新达平衡,容器A、B相通,B的体积将减小;(4)假设B的体积为A的两倍,则平衡时C的浓度w3 ="2" w1,而题中A、B的体积相等,所以B中反应向正反应方向进行,则w3 >2 w1
(5)因为反应前后气体的化学计量数之和不相等,所以压强和平均相对分子质量可以作为平衡状态的标志,(6)要增大反应速率,且使平衡正向移动,可增大B2的浓度。
考点:化学反应的平衡状态、及其平衡移动。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义。
(1)合成氨的原理为:N2(g)+3H2 2NH3 △H=" -" 92.4kJ/mol
2NH3 △H=" -" 92.4kJ/mol
①将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,平衡时测得N2为0.1 mol,H2为0.3 mol,NH3为0.1 mol。该条件下H2的转化率为 。
此温度下该反应的平衡常数K= 。
②欲提高H2的转化率,下列措施可行的是 。
a.向容器中按原比例再充入原料气
b.向容器中再充入惰性气体
c.改变反应的催化剂
d.液化生成物分离出氨
(2)在2L密闭容器中,800℃时反应2NO(g)+O2(g)  2NO2(g) △H<0体系中,各成分浓度随时间的变化如图:
2NO2(g) △H<0体系中,各成分浓度随时间的变化如图:
①用O2表示从0~2s内该反应的平均速率v=___________。
②能说明该反应已经达到平衡状态的是_________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变
③为使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
(3)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是______(填代号)。
4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是______(填代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
大气固氮和合成氮是周氮的重要形式。下表是大气固氮和合成氨的部分K值:
| | N2+O2 2NO 2NO | N2+3H2 2NH3 2NH3 | ||
| 温度 | 25℃ | 2000℃ | 25℃ | 400℃ |
| 平衡常数K | 3.84×10-31 | 0.1 | 5×108 | 200 |
 Cu(NH3)2AC·CO(aq)+Q(Q>0)
Cu(NH3)2AC·CO(aq)+Q(Q>0) NH4++NH2-。
NH4++NH2-。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某温度时,在一个容积为2 L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为______________;
(2)反应开始至2 min,用气体Z表示的反应速率为_____;
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的________倍;
②若此时将容器的体积缩小为原来的 0.5倍,达到平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应的正反应为________反应(填“放热”或“吸热”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在450℃并有催化剂存在下,在体积为1L的密闭恒温容器中,二氧化硫和氧气发生如下反应:2SO2+O2 2SO3
2SO3
(1)已知:64g SO2完全转化为SO3会放出85kJ热量。SO2转化为SO3的热化学方程式是 。
(2)该反应的化学平衡常数表达式K= 。
(3)降低温度,化学反应速度 。该反应K值将 。压强将 。(填“增大”或“减小”或“不变”)
(4)450℃时,在一密闭容器中,将二氧化硫与氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间段是 。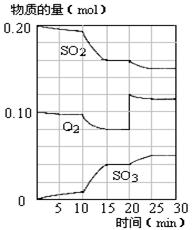
a.10-15min b.15-20min c.20-25min d.25-30min
(5)据图判断,10min到15min的曲线变化的原因可能是 (填写编号)。
a.增加SO3的物质的量 b.缩小容器体积 c.降低温度 d.催化剂
(6)在15分钟时,SO2的转化率是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一定体积的密闭容器中,进行化学反应CO2 (g)+H2 (g) CO (g)+H2O (g),其化学平衡常数K和温度t的关系如下表:
CO (g)+H2O (g),其化学平衡常数K和温度t的关系如下表:
| t / ℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高炉炼铁过程中发生的主要反应为1/3Fe2O3(s) + CO(g) 2/3Fe(s) + CO2(g)
2/3Fe(s) + CO2(g)
已知该反应在不同温度下的平衡常数如下:
请回答下列问题:
(1)该反应的平衡常数表达式K=_____________,△H________0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min达到平衡。求该时间范围内反应的平均反应速率υ(CO2)=" _________" 、CO的平衡转化率= _____________:
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
| A.减少Fe的量 |
| B.增加Fe203的量 |
| C.移出部分CO2 |
| D.提高反应温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某些金属及金属氧化物对H2O2的分解反应具有催化作用,请回答下列问题: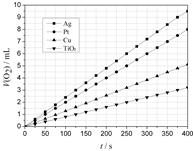
(1)已知:2H2O2(aq) =" 2" H2O (l) + O2(g) 的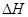 < 0, 则该反应的逆反应能否自发进行? (填“能”或“不能”),判断依据是 。
< 0, 则该反应的逆反应能否自发进行? (填“能”或“不能”),判断依据是 。
(2)某同学选用Ag、Pt、Cu、TiO2作为催化剂,在25℃ 时,保持其它实验条件相同,测得生成的O2体积(V)。V与分解时间(t)的关系如图所示(O2的体积已折算成标准状况),则:在不同催化剂存在下,H2O2分解反应的活化能大小顺序是 Ea( ) > Ea( ) > Ea( ) > Ea( ) (括号内填写催化剂的化学式)金属Pt 催化下,H2O2分解的反应速率v(O2) = mol·s-1
(3)为研究温度对H2O2分解速率的影响(不加催化剂),可将一定浓度和体积的H2O2置于密闭容器中,在某温度下,经过一定的时间t,测定生成O2的体积V。然后保持其它初始条件不变,改变温度T,重复上述实验。获得V(O2) ~ T关系曲线。下列趋势图最可能符合实测V(O2) ~ T关系曲线的是 ,原因是 。
| A. | B. | C. | D. (4)以Pt为电极电解H2O2也可产生氧气,写出H2O2水溶液电解过程中的电极反应式(已知:H2O2的氧化性及还原性均比H2O强):阴极;阳极 。 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某恒容容器内发生的可逆反应的化学平衡常数表达式为: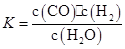 。能判断该反应一定达到化学平衡状态的依据是( )
。能判断该反应一定达到化学平衡状态的依据是( )
①容器中气体的平均相对分子质量不随时间而变化
②v正(H2O)=v逆(H2)
③容器中气体的密度不随时间而变化
④容器中气体总质量不随时间而变化
⑤消耗n mol H2的同时消耗n mol CO
| A.①②③ | B.①②③④ | C.② | D.①④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com