
| A. | 原子半径大小顺序为W>X>Z>Y | |
| B. | W元素形成的可溶性盐溶液一定显酸性 | |
| C. | M、X只能形成离子化合物,且形成的离子化合物中只含离子键 | |
| D. | W的最高价氧化物与Z、M的最高价氧化物的水化物均能反应 |
分析 X、Y、Z、W、M五种短周期元素,Y形成化合物种类最多,则Y为C元素;M为短周期主族元素中原子半径最大的元素,则M为Na;X2-、W3+具有相同的电子层结构,X、Y同周期,则X为O元素、W为Al;X、Z同主族,则Z为S元素,据此解答.
解答 解:X、Y、Z、W、M五种短周期元素,Y形成化合物种类最多,则Y为C元素;M为短周期主族元素中原子半径最大的元素,则M为Na;X2-、W3+具有相同的电子层结构,X、Y同周期,则X为O元素、W为Al;X、Z同主族,则Z为S元素.
A.同周期自左而右原子半径减小,一般电子层越多原子半径越大,故原子半径:W(Al)>Z(S)>Y(C)>X(O),故A错误;
B.铝盐溶液呈酸性,但偏铝酸盐溶液呈碱性,故B错误;
C.钠与氧形成氧化钠、过氧化钠,均属于离子化合物,但过氧化钠中含有共价键,故C错误;
D.氧化铝属于两性氧化物,既能与硫酸又能与氢氧化钠反应,故D正确,
故选:D.
点评 本题考查位置结构性质的关系和应用,推断元素是解题关键,B选项为易错点,学生容易忽略偏铝酸盐,注意对元素周期律的理解掌握.


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:选择题
| 共价键 | H-H | Cl-Cl | H-Cl |
| E (kJ •mol-1) | 436 | 243 | 432 |
| A. | H2(g)+Cl2(g)=2HCl (g)△H=+247 kJ•mol-1 | |
| B. | H (g)+Cl (g)→HCl (g)△△H=+432 kJ•mol-1 | |
| C. | 1 mol H2(g) 与1 mol Cl2(g) 的总能量高于2 mol HCl (g) 的总能量 | |
| D. | 用电子式表示HCl的形成过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
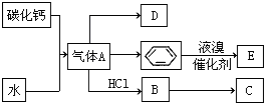 已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实.根据以下化学反应框图填空:
已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实.根据以下化学反应框图填空: ;C的结构简式
;C的结构简式 ;
; +Br2 $\stackrel{FeBr_{3}}{→}$
+Br2 $\stackrel{FeBr_{3}}{→}$ +HBr;其反应类型为取代反应.
+HBr;其反应类型为取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用丁达尔效应可区分溶液和胶体 | |
| B. | 能使湿润的监色石蕊试纸变红的气体是NH3 | |
| C. | 观察钾元素的焰色反应时要透过监色钴玻璃 | |
| D. | 检验溶液中SO42-存在时,先加盐酸酸化,再加氯化钡溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.336L | B. | 0.224L | C. | 0.168L | D. | 0.504L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上粗硅的制备和提纯 | B. | 工业上从海水中提取溴或镁 | ||
| C. | 工业上采用“侯氏制碱法”制纯碱 | D. | 工业上利用合成氨实现氮的固定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com