
| A. | 等于p% | B. | 大于p% | C. | 小于p% | D. | 无法判断 |
 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛、乙醛、丙醛通常情况下都是液体 | |
| B. | 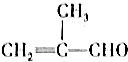 是乙醛的同系物 是乙醛的同系物 | |
| C. | 可用浓盐酸洗去银镜反应实验生成的银镜 | |
| D. | 1mol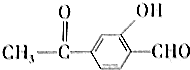 最多能与5mol H2发生反应 最多能与5mol H2发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝在空气中耐腐蚀,所以铝是不活泼金属 | |
| B. | 铝能与冷水反应 | |
| C. | 铝热反应常用于冶炼某些熔点较高的金属 | |
| D. | 冶炼铝可用电解AlCl3的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | H2 | CO | CH4 | CH3COOH |
| 燃烧热(kJ/mol) | 286 | 283 | 890 | 874 |
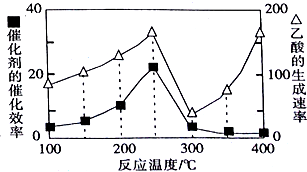
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
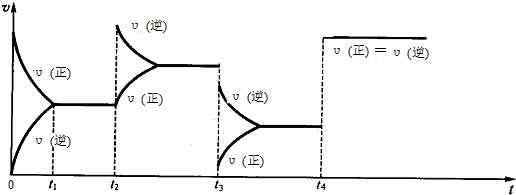
| 时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 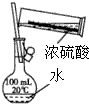 稀释浓硫酸 | |
| B. | 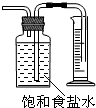 测量Cl2的体积 | |
| C. | 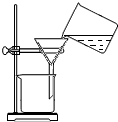 过滤 | |
| D. | 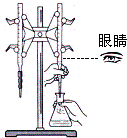 用NaOH标准溶液滴定锥形瓶中的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  表示10 mL 0.01mol•L-1KMnO4酸性溶液与过量的0.1mol•L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用) | |
| B. | 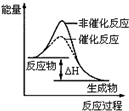 表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| C. | 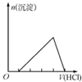 表示示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀物质的量与盐酸体积的关系 | |
| D. | 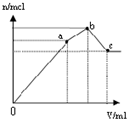 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com