
| 编号 | 实验内容 | 实验目的 |
| A | 向盛有10滴0.1 mol/LAgNO3溶液的试管中滴加0.1 mol/NaCl容液,至不再有沉淀生成,再向其中滴加0.lmol/LNa2S 溶液 | 证明在相同温度下,溶解度:AgCl>Ag2S |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO2溶液中存在水解平衡 |
| C | 分别向2mL甲苯、2mL苯、2niL正己烷中加入 3滴酸性高锰酸钾溶液,振荡,甲苯中酸性高锰酸钾溶液褪色,而苯、正己烷中酸性高锰酸钾溶液不褪色 | 证明与苯环相连的甲基易被氧化 |
| D | 取两只试管,分别加入4mL0.01mol/L KMn04酸性溶液,然后向一只试管中加入0.1mol/LH2C2O4溶液2mL,向另一只试管中加入0.1mol/LH2C2O4液4mL记录褪色时间 | 证明草酸浓度越大反应速率越快 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.溶度积常数大的物质能转化为溶度积常数小的物质;
B.Na2CO3溶液水解显碱性,加BaCl2溶液后水解平衡逆向移动,氢氧根离子浓度减小;
C.正己烷和苯不与酸性高锰酸钾溶液反应,甲苯和酸性高锰酸钾溶液反应;
D.加入不同体积的草酸,溶液体积不同,高锰酸钾和草酸溶液的浓度都不同.
解答 解:A.再向其中滴加0.1mol/LNa2S溶液,会生成黑色沉淀,说明有Ag2S生成,可说明Ag2S的溶解性更小,故A正确;
B.碳酸钠溶液中存在CO32-+H2O?HCO3-+OH-,加入氯化钡溶液生成碳酸钡沉淀,平衡向逆反应方向移动,溶液中氢氧根离子浓度降低,溶液颜色变浅,可证明存在平衡,故B正确;
C.甲苯可与酸性高锰酸钾反应生成苯甲酸,而苯、正己烷不反应,说明与苯环相连的甲基易被氧化,故C正确;
D.加入不同体积的草酸,溶液体积不同,高锰酸钾和草酸溶液的浓度都不同,有两个变量,不能证明草酸浓度与反应速率关系,故D错误;
故选D.
点评 本题考查化学实验方案评价,为高频考点,明确实验原理及物质性质是解本题关键,注意实验的严密性及规范性,易错选项是D,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
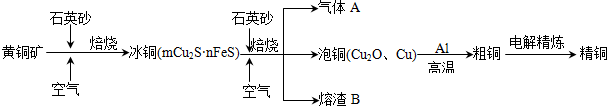
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
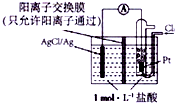
| A. | 正极为Pt电极,电极反应为2Ag++Cl2+2e-═2AgCl↓ | |
| B. | 放电时,交换膜两侧溶液中盐酸浓度不变 | |
| C. | 若用NaCl溶液代替盐酸,则电池总反应随之改变 | |
| D. | 当电路中转移0.01mole-时,交换膜左侧溶液中约减少0.02mol离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
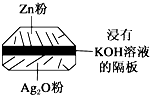 (1)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2$S{O}_{4}^{2-}$$?_{充电}^{放电}$2PbSO4+2H2O.请回答下列问题(不考虑氢、氧的氧化还原):
(1)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2$S{O}_{4}^{2-}$$?_{充电}^{放电}$2PbSO4+2H2O.请回答下列问题(不考虑氢、氧的氧化还原):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液:Na+、K+、SO42-、AlO2- | |
| B. | KW/c(OH-)=0.1mol/L的溶液:Na+、Mg2+、NO3-、S2- | |
| C. | 无色溶液:Na+、Ca2+、I-、NO3- | |
| D. | 能使甲基橙呈黄色的溶液:H+、ClO-、Fe2+、Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验 | 操作 |
| A | 测定次氯酸钠的pH | 用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,变色后,与标准比色卡对比 |
| B | 配制一定浓度的氯化钾溶液1000mL | 准确称取氯化钾固体,放入到1000mL的容量瓶中,加水溶解,振荡摇匀,定容 |
| C | 排除碱式滴定管尖嘴部分的气泡 | 将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴快速流出 |
| D | 取出分液漏斗中所需的上层液体 | 将下层液体从分液漏斗下端管口放出后,关闭活塞,换一个接收容器,从分液漏斗下端管口继续放出下层液体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮原子结构示意图: | B. | 乙烯的结构式:CH2CH2 | ||
| C. | 含有10个中子的氧原子:${\;}_{10}^{18}$O | D. | 苯的结构简式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲升高温度,乙不变 | B. | 甲中加入0.1molHe,乙不变 | ||
| C. | 甲、乙提高相同温度 | D. | 甲增加0.1molH2,乙不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑥③⑧⑤①② | B. | ⑥⑤③①⑧② | C. | ④⑤③②①⑧ | D. | ⑥②⑤①③② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com